š┐╗Ŕ»Ĺ |┬áNina
Ŕ┤úš╝ľ | Ú╗ĹŠ░┤ń╗Ö┬áÚúÄňŐĘňşÉ
ŠťČŠťčCellňĆĹŔíĘ2š»çPreviewsŃÇü1š»çReviewŃÇü11š»çArticlesňĺî4š»çResourcesŃÇ銝Ț»çÚ珚úůš╗╝Ŕ┐░ňŤ×Úíżń║ćň»╣ňşÉň«źňćůŔćťň╝éńŻŹšŚçšŚůňŤášÉćŔžúšÜ䊝NJľ░Ŕ┐Ťň▒Ľ´╝îŔ«ĘŔ«║ňŻôň돚ÜäŔ»ŐŠľşňĺîŠ▓╗šľŚň돊ֻŃÇéÚŽľŠČíň«×šÄ░ň«×ŠŚÂŔžéŠÁőňŹĽńެŠľ░šöčRNAňłćňşÉšÜäňÉłŠłÉňĺîň묊ĹňŐĘŠÇüŠÇž´╝îńŻ┐ń║║š▒╗ň»╣ń║ÄŔŻČňŻĽŃÇüňë¬ňłçšşëŔ┐çšĘőňťĘňŹĽš╗ćŔâ׊░┤ň╣│ńŞŐŔ┐ŤńŞÇŠşąňó×ňŐáń║抌ÂÚŚ┤š╗┤ň║Ž´╝îńŞ║mRNAšľŚŠ│ĽÚóćňččň╝ÇŔżčŠľ░ŠÇŁŔĚ»ŃÇéÚÇÜŔ┐çňŹĽš╗ćŔâ×ŔŤőšÖŻŠ┤╗ŠÇžňłćŠ×É´╝îňĆĹšÄ░ń║ćńŞÇšžŹšŻĽŔžüšÜ䊝¬ščąšÜäňĚĘňÖČš╗ćŔâ×´╝îňůÂńŞÄŔéżÚÇĆŠśÄš╗ćŔâךÖîňĄŹňĆĹš┤žň»ćšŤŞňů│´╝îńŞ║ň╝ÇňĆĹŠ▓╗šľŚŔéżšÖîňĄŹňĆĹšÜäňÇÖÚÇëڣŠáçňąáň«Üňč║šíÇŃÇé

ńŞÇŃÇüÚ珚úůš╗╝Ŕ┐░ÔÇöÔÇöňşÉň«źňćůŔćťň╝éńŻŹšŚç´╝ÜšŚůňŤáňşŽŃÇüšŚůšÉćňşŽňĺîŠ▓╗šľŚň돊ֻ┬á┬á
ŠťČš»çŠś»ŠŁąŔç¬Ŕő▒ňŤŻšł▒ńŞüňáíňĄžňşŽšÜäPhilippa T.K. SaundersŠĽÖŠÄłňĆĹŔíĘšÜäReviewŃÇéňşÉň«źňćůŔćťň╝éńŻŹšŚçŠś»ńŞÇšžŹńŞÄńŞŹňşĽšŚçšŤŞňů│šÜäňŞŞŔžüšľżšŚů´╝îń╝Üň»╝Ŕç┤Ŕ«ŞňĄÜňą│ŠÇžšÜäŠůóŠÇžšľ╝šŚŤŃÇéň«âšÜäň«Üń╣늜»ňşÉň«źňĄľňşśňťĘš▒╗ń╝╝ňşÉň«źňćůŔćťšÜäš╗äš╗çŃÇéň░Żš«íŔ»ąšľżšŚůšÜ䚌ůňŤáňĺîŔ笚䚌ůšĘőń╗ŹńŞŹší«ň«Ü´╝îńŻćŠ┐Çš┤áŃÇüšą×š╗ĆňĺîňůŹšľźňŤáš┤áÚâŻńŞÄň»╝Ŕç┤šŚçšŐÂňĆĹň▒ĽšÜ䊝║ňłÂŠťëňů│ŃÇéňŤáńŞ║ÚťÇŔŽüŠëőŠť»ŠŁąŠśÄší«Ŕ»ŐŠľş´╝îŠëÇń╗ąňťĘšŚçšŐÂňç║šÄ░ňÉÄÚÇÜňŞŞń╝ÜŠťëňżłÚĽ┐šÜäŔ»ŐŠľşň╗ÂŔ┐čŃÇ隍«ň돊▓╗šľŚňşÉň«źňćůŔćťň╝éńŻŹšŚçšÜäň╣▓ÚóäŠÄ¬ŠľŻšľŚŠĽłŠťëÚÖÉ´╝îńŞöňşśňťĘńŞŹňĆ»ŠÄąňĆŚšÜäňë»ńŻťšöĘňĺîÚúÄÚÖę´╝îńŞöšŚçšŐÂňĄŹňĆĹšÄçÚźśŃÇ銝Ț»çš╗╝Ŕ┐░ňŤ×Úíżń║ćň»╣ňşÉň«źňćůŔćťň╝éńŻŹšŚçšŚůňŤášÉćŔžúšÜ䊝NJľ░Ŕ┐Ťň▒Ľ´╝îŔ«ĘŔ«║ňŻôň돚ÜäŔ»ŐŠľşňĺîŠ▓╗šľŚšşľšĽą´╝üňç║ňŻôň돚ÜäńŞ┤ň║ŐŔ»ĽÚ¬î´╝îň╣ŠÄóŔ«ĘŠťÇŔ┐ĹšÜäšáöšęŠłÉŠ×ťňŽéńŻĽńŞ║Ŕ»ćňłźňşÉň«źňćůŔćťň╝éńŻŹšŚçšöčšëęŠáçň┐Śšëę´╝îň╣Âň╝ÇňĆĹŠťëŠĽłšÜäń┐ŁšĽÖšöčŔé▓ŔâŻňŐŤšÜäڣ׊ëőŠť»šľŚŠ│ĽŃÇé´╝łŠĹśŔŽü´╝ë
´╝łňÄ芾çÚôżŠÄą´╝Ühttps://doi.org/10.1016/j.cell.2021.03.008´╝ë
ŠŐĽŔÁäÚó䊝č´╝ÜŔżůňŐęšö芫ľňŞéňť║šÜäň돊ֻňĆ»ŠťčňşÉň«źňćůŔćťň╝éńŻŹšŚçňťĘňůĘšÉâŔé▓ÚżäňŽçňą│ŠéúšŚůšÄçš║ŽńŞ║10%´╝îÚźśŔżż35%-50%šÜäŠéúŔÇůňç║šÄ░ŠůóŠÇžÚ¬ĘšŤćšľ╝šŚŤŠłľńŞŹňşĽŃÇé
ňůĘšÉâš║ŽŠťë1.8ń║┐ŠéúŔÇů´╝îňŞéňť║ŔžäŠĘíÚźśŔżżňçáňŹüń║┐šżÄÚçĹŃÇ銏«ŠŐąÚüô´╝îń║ÜŠ┤▓ňą│ŠÇžšÜäňşÉň«źňćůŔćťň╝éńŻŹšŚçŠéúšŚůšÄçÚźśń║ÄŠČžšżÄňĆŐڣ׊┤▓ňą│ŠÇžŃÇéŔĆ▓ňżőň«żŃÇüňŹ░ň║ŽŃÇüŠŚąŠťČňą│ŠÇžšÜäňşÉň«źňćůŔćťň╝éńŻŹšŚçŠéúšŚůšÄçńŞ║15.7%´╝żŔĹŚÚźśń║ÄŠČžšżÄňą│ŠÇžšÜä5.8%ŃÇéňşÉň«źňćůŔćťň╝éńŻŹšŚçÚÇÜňŞŞň╝ĽŔÁĚšöčŠ┤╗Ŕ┤ĘÚçĆšÜäńŞőÚÖŹ´╝îňŻ▒ňôŹŠéúŔÇůšÜäŠÇžšöčŠ┤╗ŃÇüň┐âšÉćňĆŐňůšĄżń╝ÜŔíîńŞ║ŃÇéňşÉň«źňćůŔćťň╝éńŻŹšŚçšÜ䚌ůňŤáň░ÜńŞŹŠŞůŠąÜ´╝îŔÇîńŞöŠŚáŠ│ĽŠ▓╗ŠäłŃÇ隍«ň돴╝îňćůň╝隌çŠéúŔÇůńŞ╗ŔŽüÚççňĆľŠëőŠť»ŠłľŔÇůŔŹ»šëęŠ▓╗šľŚ´╝îň░Żš«íŠëőŠť»Š▓╗šľŚňĆ»Šö╣ňľäňůšŤŞňů│šľ╝šŚŤŃÇüšöčŠ┤╗Ŕ┤ĘÚçĆňĺîŠÇžňŐčŔ⯴╝îňŹ┤ň«╣Šśôň╝ĽňĆĹŔéáÚüôŃÇüŠ│îň░┐ÚüôňĺîŔíÇš«íň╣ÂňĆĹšŚçŃÇéňćůň╝隌çŠéúŔÇůňťĘÚĽ┐ŠťčŠ▓╗šľŚŔ┐çšĘőńŞş´╝áŔ«║Šś»ňÉŽŠÄąňĆŚŠëőŠť»Š▓╗šľŚ´╝îňŁçÚťÇŔŽüŔŹ»šëęŠ▓╗šľŚń╗ąŠö╣ňľäšľ╝šŚŤšŚçšŐÂňĺîÚóäÚś▓ňĄŹňĆĹŃÇéňşÉň«źňćůŔćťň╝éńŻŹšŚçŠś»ÚŤîŠ┐Çš┤áńżŁŔÁľŠÇžšľżšŚů´╝îň╝éńŻŹňćůŔćťńŞÄŠşúňŞŞńŻŹšŻ«ňşÉň«źňćůŔćťńŞÇŠáĚ´╝îňĆŚňŹÁňĚóňłćŠ│îšÜäÚŤîŠ┐Çš┤áŃÇüňşĽŠ┐Çš┤ášÜäňŻ▒ňôŹ´╝ůňŁçŔ«ĄńŞ║ÚççšöĘŠ┐Çš┤áÚÖŹńŻÄńŻôňćůÚŤîŠ┐Çš┤áŠ░┤ň╣│´╝îń╗ąŔżżňł░ÚŚşš╗Ćňĺîń┐âńŻ┐ň╝éńŻŹňćůŔćťŔÉÄš╝ꊜ»Š▓╗šľŚŔ»ąšŚçšÜ䊝늼łŔŹ»šëęšľŚŠ│ĽŃÇ隍«ň돚ÜäŠáçňçćŠ▓╗šľŚń┐âŠÇžŔů║Š┐Çš┤áÚçŐŠöżŠ┐Çš┤áš▒╗ń╝╝šëęŔÖŻšäÂňĆ»ń╗ąš╝ôŔžúšľ╝šŚŤ´╝îńŻćňÉÂň╝ĽŔÁĚšéÄšŚçňë»ńŻťšöĘ´╝îňîůŠőČÚ¬ĘŔ┤ĘšľĆŠŁż´╝«šâşšşë´╝îňŤáŠşĄŠŚáŠ│ĽÚĽ┐ŠťčńŻ┐šöĘŃÇéńŞ┤ň║ՊǹڝǚľŚŠĽłší«ňłçŃÇüňë»ńŻťšöĘńŻÄšÜ䊾░šľŚŠ│ĽŃÇé
ŠáŞň┐âŠŐÇŠť»šŚŤšé╣´╝ÜÚĽ┐ŠťčŠ┐Çš┤áŠ▓╗šľŚňë»ňĆŹň║öŠśÄŠśż´╝îŠÇąÚťÇň╝ÇňĆĹňłŤŠľ░ڣšé╣šÜäڣ׊┐Çš┤áŔŹ»šëę
šö▒ń║Äňćůň╝隌çŠ×üŠśôňĄŹňĆĹńŞöÚťÇŔŽüÚĽ┐ŠťčŠ▓╗šľŚ´╝îŔÇîńŞ┤ň║ŐńŞŐšŤ«ňëŹňĆ»ŔÄĚňżŚšÜäŔŹ»šëęňŤáňůŠťëŠĽłŠÇžňĺîŔÇÉňĆŚŠÇžÚŚ«Úóś´╝îňżÇňżÇŠŚáŠ│ĽŠö»ŠîüÚĽ┐ŠťčšöĘŔŹ»´╝«ňëŹŔ»ąšŚůšÜäŠ▓╗šľŚń╗ŹÚŁóńŞ┤ňĚĘňĄžŠîĹŠłśŃÇéň»╗ŠëżŔÇÉňĆŚŠÇžňąŻŃÇüńŞŹŔë»ňĆŹň║öńŻÄŃÇüńżŁń╗ÄŠÇžŠŤ┤ńŻ│šÜäňůĚŠťëňłŤŠľ░ڣšé╣šÜäڣ׊┐Çš┤áŔŹ»šëęň░ĄńŞ║ÚçŹŔŽüŃÇé
ňŤŻňćůŠŐĽŔÁäŠíłńżő´╝ÜňĺîňůšĹ×ňî╗ŔŹ»ň«îŠłÉ5600ńŞçšżÄňůâšÜäBŔŻ«Ŕ׏ŔÁäHope Medicine Inc.
´╝łňĺîňůšĹ×ňî╗ŔŹ»´╝늳ɚźőń║Ä2018ň╣┤´╝îńŻŹń║ÄňŹŚń║Č´╝»ńŞÇň«ÂŔç┤ňŐŤń║ÄŠ║ÉňĄ┤ňłŤŠľ░ŃÇüšžĹňşŽÚę▒ňŐĘň×őšÜäňłŤŠľ░ŔŹ»šáöňĆĹňůČňĆŞ´╝îňŤ┤š╗Ľňą│ŠÇžňüąň║ĚŃÇüňćůňłćŠ│îňĺîň┐âŔíÇš«íńŞëňĄžšľżšŚůÚóćňčč´╝îÚĺłň»╣šŤ«ňëŹňÉäÚí╣ńŞ┤ň║ŐŠť¬ŔóźŠ╗íŔÂ│šÜäڝNJ▒é´╝îÚÇÜŔ┐çŔç¬ńŞ╗šáöňĆĹňĺîLicense-inňĆîÚę▒ňŐĘŠĘíň╝Ć´╝îŔ┐ŤńŞÇŠşąň╗║šźőňĄÜŠáĚňîľšáöňĆĹš«íš║┐ŃÇéňĺîňůšĹ×ńŞÄŠőťŔÇ│ňůČňĆŞ(Bayer AG)ň░▒ň╝ÇňĆĹńŞÄń║žńŞÜňîľÚŁÂňÉĹŠ│îń╣│š┤á(PRL)ňĆŚńŻôšÜäňŹĽňůőÚÜćŠŐŚńŻôšşżšŻ▓ńŞÇÚí╣ňůĘšÉâšőČň«ÂŔ«ŞňĆ»ňŹĆŔ««ŃÇéŔ»ąŠŐŚńŻôšÜ䊯ťňťĘÚÇéň║öšŚçňîůŠőČšöĚŠÇžńŞÄňą│ŠÇžŔä▒ňĆĹšŚçŃÇüňşÉň«źňćůŔćťň╝éńŻŹšŚçŃÇüń╗ąňĆŐňůÂň«âŠůóŠÇžšľżšŚůŃÇéńżŁšůžŔ«ŞňĆ»ňŹĆŔ««´╝îňĺîňůšĹ×ňî╗ŔŹ»ň░ćňč║ń║ÄŠőťŔÇ│šÜäščąŔ»ćń║žŠŁâ´╝îňťĘňůĘšÉâň╝Çň▒ĽÚŁÂňÉĹŠ│îń╣│š┤á´╝łPRL´╝ëňĆŚńŻôšÜäňůĘŠľ░ŠŐŚńŻôšÜäň╝ÇňĆĹňĺîń║žńŞÜňîľ´╝ŤŠőťŔÇ│ň░ćŔÄĚňżŚÚŽľŠťčÚóäń╗śŠČżŃÇüň╝ÇňĆĹÚçîšĘőšóĹŃÇüňĽćńŞÜňîľÚçîšĘőšóĹňĺîڜŠó»ň╝ĆÚöÇňö«ŠĆÉŠłÉŃÇ隍«ň돴╝îHMI-115ňĚ▓ňťĘŠČžšŤčň«îŠłÉIŠťčńŞ┤ň║ŐŔ»ĽÚ¬î´╝îň«ëňůĘŠÇžŔë»ňąŻ´╝îňŹ│ň░ćňÉ»ňŐĘÚŤäŠ┐Çš┤áŠÇžŔä▒ňĆĹŃÇüňşÉň«źňćůŔćťň╝éńŻŹšŚçšÜäňůĘšÉâňĄÜńŞşň┐âIIŠťčńŞ┤ň║ŐŔ»ĽÚ¬îŃÇé2021ň╣┤5Šťł´╝îňĺîňůšĹ×ňî╗ŔŹ»ň«úňŞâň«îŠłÉ5600ńŞçšżÄňůâBŔŻ«Ŕ׏ŔÁä´╝ČŔŻ«Ŕ׏ŔÁäšö▒ňÉ»ŠśÄňłŤŠŐĽŃÇüŔ┐ťš┐╝ŠŐĽŔÁäňů▒ňÉîÚóćŠŐĽ´╝îň╝śŠÖľŔÁ䊝ČńŞÄňłŤŠľ░ňĚąňť║ŔĚčŠŐĽ´╝îŔÇüŔéíńŞťŠîÜń┐íŔÁ䊝Ȋîüš╗şňŐáŠîü´╝îŠÁęŠéŽŔÁ䊝Ȋőůń╗╗ŠťČŔŻ«Ŕ׏ŔÁäšÜäšőČň«ÂŔ┤óňŐíÚíżÚŚ«ŃÇ銝ČŔŻ«ŠŐĽŔÁäň░ćń╝ÜńŞ║ňĺîňůšĹ×ňŹ│ň░ćň╝ÇňÉ»šÜäMRCTňŤŻÚÖůń║čńŞ┤ň║ŐšáöšęÂňĺîń║žňôüš║┐ň╗║Ŕ«żŠĆÉńżŤň╝║ŠťëňŐŤšÜäŠö»ŠîüŃÇé
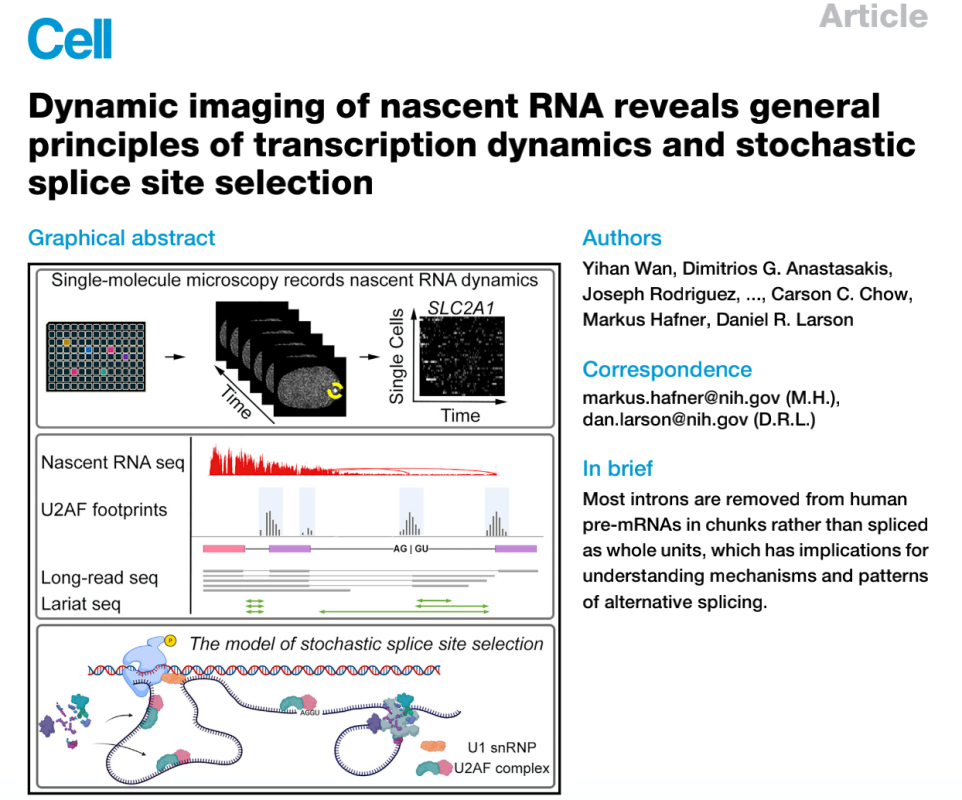
ń║îŃÇüÚŽľŠČíň«×šÄ░ňťĘňćůŠ║Éňč║ňŤáńŞşň«×ŠŚÂŔžéň»čň묊ĹňŐĘŠÇüŠÇž´╝ÜŠľ░šöčRNAšÜäňŐĘŠÇüŠłÉňâĆŠĆşšĄ║ŔŻČňŻĽňŐĘňŐŤňşŽňĺîÚÜĆŠť║ň묊ĹńŻŹšé╣ÚÇëŠőęšÜäÚÇÜšöĘňÄčňłÖ
ŠťČš»çŠś»ŠŁąŔ笚żÄňŤŻňŤŻň«ÂšÖçšáöšęÂńŞşň┐âšÜäDaniel R. LarsonňŤóÚśčňĆĹŔíĘšÜäArticleŠľçšźáŃÇéRNAŔüÜňÉłÚůÂňĺîň묊ĹńŻôšÜäŠ┤╗ŠÇžŠś»ÚÇኳÉń║║š▒╗š╗ćŔâ×ńŞşmRNAńŞ░ň║ŽňĺîňÉîňĚąň×őš╗䊳Éň╝éŔ┤ĘšÜäňÄčňŤáŃÇéšäÂŔÇî´╝îň░ÜŠť¬ŠĆĆŔ┐░Ŕ┐Öń║ŤňćůŠ║Éňč║ňŤáňŹĆňÉîńŻťšöĘšÜäÚůÂňĄŹňÉłšëęňŐĘňŐŤňşŽŃÇéšáöšęÂń║║ňĹśň╗║šźőń║ćńŞÇńެňçćňč║ňŤáš╗äŔžäŠĘíšÜäň╣│ňĆ░´╝îňĆ»šöĘń║Äň«×ŠŚÂŔžéň»čňŹĽńެŠľ░šöčRNAňłćňşÉšÜäňÉłŠłÉňĺîňŐĘňŐŤňşŽŃÇéšáöšęÂń║║ňĹśňĆĹšÄ░ŠëÇŠťëŔžéň»čňł░šÜäňč║ňŤáÚ⯊śżšĄ║ňç║ŔŻČňŻĽšłćňĆĹŃÇéšáöšęÂń║║ňĹśŔ┐śŔžéň»čňł░ňŹĽńެš╗ćŔâ×ńŞşňŹĽńެňćůňÉźňşÉšÜäňÄ╗ÚÖĄňŐĘňŐŤňşŽňĆśňîľŔżâňĄž´╝îŔ┐ÖńŞÄší«ň«ÜŠÇžň묊ĹńŻŹšé╣šÜäÚÇëŠőęńŞŹńŞÇŔç┤ŃÇéU2AFňĄŹňÉłšëęšÜäŔŻČňŻĽš╗äŔîâňŤ┤ňćůšÜäŔÂ│Ŕ┐╣ŃÇüŠľ░šöčRNAňłćŠ×ÉŃÇüÚĽ┐Ŕ»╗ŠÁőň║ĆňĺîňąŚš┤óŠÁőň║ĆŔ┐ŤńŞÇŠşąŠĆşšĄ║ń║ćňćůňÉźňşÉňćůÚâĘň╣┐Š│ŤšÜäÚÜĆŠť║ÚÇĺňŻĺň묊ĹŃÇéšáöšęÂń║║ňĹśŠĆÉňç║ň╣ÂÚ¬îŔ»üń║ćš╗čńŞÇšÜäšÉćŔ«║ŠĘíň×ő´╝îňĆ»šöĘń║ÄŔžúÚçŐŔŻČňŻĽňĺîŠÖ«ÚüŹÚÜĆŠť║ň묊ĹńŻŹšé╣ÚÇëŠőęšÜäńŞÇŔłČšë╣ňżüŃÇé´╝łŠĹśŔŽü´╝ë
´╝łňÄ芾çÚôżŠÄą´╝Ühttps://doi.org/10.1016/j.cell.2021.04.012´╝ë
ňťĘňÄ╗ň╣┤Šľ░ňćášľźŠâůšłćňĆĹňÉÄ´╝îŠáŞÚůŞŔŹ»šëęmRNAšľźŔőŚšÜäň┐źÚÇčšáöňĆĹ´╝îńŻ┐ňżŚŠáŞÚůŞŔŹ»šëęÚóćňččň┤şÚť▓ňĄ┤ŔžĺŃÇéňŤŻňćůňĄľŔÁ䊝Ț×äňçćňůÂň║×ňĄžšÜäňŞéňť║šę║ÚŚ┤ňĆŐňĆĹň▒ĽŠŻťňŐŤ´╝îš║Ěš║ĚňŞâň▒Ç´╝îŠáŞÚůŞŔŹ»šëęšÜäšáöňĆĹŠłÉńŞ║ňůĘšÉâšéÖŠëőňĆ»šâşšÜäÚóćňččŃÇéŠáŞÚůŞš▒╗ŔŹ»šëęňłÖŠś»ňÉäšžŹňůĚŠťëńŞŹňÉîňŐčŔ⯚Üäň»íŔü܊᪚│ľŠáŞŔőĚÚůŞ(RNA)Šłľň»íŔüÜŔä▒Š░žŠáŞš│ľŠáŞŔőĚÚůŞ(DNA)´╝îŔâŻňĄčšŤ┤ŠÄąńŻťšöĘń║ÄŔç┤šŚůÚŁÂňč║ňŤáŠłľŔÇůÚŁÂmRNA´╝îňťĘňč║ňŤáŠ░┤ň╣│ńŞŐňĆŊ▓╗šľŚšľżšŚůšÜäńŻťšöĘŃÇéŠáŞÚůŞŔŹ»šëęňůŠťČŔ┤ĘŠś»ń╗ÄŔŻČňŻĽŠ░┤ň╣│Ŕ┐ŤŔíîňč║ňŤáŠ▓ëÚ╗śŠłľŠ┐ÇŠ┤╗Š▓╗šľŚŃÇéńŞÄń╝áš╗čŔŤőšÖŻŠ░┤ň╣│ňĆĹŠîąńŻťšöĘšÜäŔŹ»šëęšŤŞŠ»ö´╝îŠáŞÚůŞŔŹ»šëęňƬڝNJö╣ňĆśŠÄĺňłŚŠáŞÚůŞšÜäšó▒ňč║ň║ĆňłŚ´╝îň░▒ňĆ»ń╗ąšáöňĆĹńŞŹňÉîšÜäŔŹ»šëę´╝îňůÂň╝ÇňĆĹŔ┐çšĘőš«ÇňŹĽŃÇüÚźśŠĽłŃÇüšöčšëęšë╣ň╝éŠÇžň╝║´╝ŤńŞÄňč║ňŤáš╗äDNAŠ░┤ň╣│šÜäŠ▓╗šľŚšŤŞŠ»ö´╝îŠáŞÚůŞŔŹ»šëęŠ▓튝ëňč║ňŤáŠĽ┤ňÉłšÜäÚúÄÚÖę´╝îňťĘŠ▓╗šľŚŠŚÂÚŚ┤ŔŐéšé╣ńŞŐń╣芻öŔżâšüÁŠ┤╗´╝îňťĘńŞŹÚťÇŔŽüŠ▓╗šľŚšÜ䊌ÂňÇÖňĆ»ń╗ąňüťŠşóšöĘŔŹ»ŃÇéňůÂńŞş´╝îmRNAšľŚŠ│ĽŠś»ÚÇÜŔ┐çňĄľŠ║Éň»╝ňůąmRNAŠŁąš║ኺúňč║ňŤáŔíĘŔżżš╝║ÚÖĚŠłľň╝éňŞŞ´╝ľň░ćŔíĘŔżżŠŐŚňÄčŔŤőšÖŻšÜämRNAňłÂŠłÉšľźŔőŚŃÇémRNAŠłÉŠťČńŻÄŃÇüŔíĘŔżżŔŤőšÖŻň┐ź´╝îńŞöŠ▓튝ëňč║ňŤáŠĽ┤ňÉłÚúÄÚÖęŃÇéńŞöńŞÇŠŚŽÚŁÂšé╣ší«ň«Ü´╝îmRNAŔŹ»šëęšÜäňĆĹšÄ░ňĺîŔ«żŔ«íňĆ»šĘőň║ĆňÄĘŔ┐Ť´╝ŤmRNAŔŹ»šëęšÉćŔ«║ńŞŐňĆ»ń╗ąŔŽćšŤľňîůŠőČňŹĽŠŐŚŃÇüš╗ćŔâ׊▓╗šľŚŃÇüňč║ňŤáš╝ľŔżĹňťĘňćůšÜäŠëÇŠťëňŻôň돊ťÇšâşÚŚĘšÜ䊾░ŠŐÇŠť»ŃÇé
mRNAšÜäńŻôňćůÚÇĺÚÇüš│╗š╗芜»šŤ«ň돊ťÇňĄžšÜäŠŐÇŠť»šôÂÚół´╝ŞŔżâń║ÄňłćňşÉÚçĆŔżâň░ĆšÜäsiRNAňĺîASOšşëŠáŞÚůŞŔŹ»šëę´╝îmRNAšÜäÚÇĺÚÇüÚÜżň║ŽŠŤ┤ňĄž´╝┤ňůĚŠîĹŠłśŠÇžŃÇéňŤŻňćůŠŐĽŔÁäŠíłńżő´╝ÜmRNAŠľ░ŔŹ»šáöňĆĹń╝üńŞÜÔÇťŠľ»ňż«šöčšëęÔÇŁŔÄĚŔ┐Ĺ2ń║┐šżÄňů⊾░ńŞÇŔŻ«Ŕ׏ŔÁä2021ň╣┤6Šťł3ŠŚą´╝îmRNAŠľ░ŔŹ»šáöňĆĹń╝üńŞÜÔÇťŠľ»ňż«šöčšëęÔÇŁň«úňŞâŠşúň╝Ćň«îŠłÉŔ┐Ĺ2ń║┐šżÄňů⊾░ńŞÇŔŻ«Ŕ׏ŔÁäŃÇ銝ČŔŻ«Ŕ׏ŔÁäšö▒ŠőŤňĽćňüąň║ĚŃÇüš║óŠŁëŔÁ䊝ČńŞşňŤŻňč║ÚçĹŃÇüŠÖ»Š×ŚŠŐĽŔÁäŃÇüŔŹ»ŠśÄň║ĚňżĚňů▒ňÉîÚóćŠŐĽ´╝îňąąňŹÜŔÁ䊝ČŃÇüň░ÜšĆ╣ŠŐĽŔÁäŃÇüňŤŻŠľ░ňŤŻňÉîŃÇüŠőŤÚôÂňŤŻÚÖůŃÇüňç»ňłęŠśôŠľ╣ŔÁ䊝ČŃÇüňůëŔ┐ťŔÁ䊝ČŃÇüŠŞůŠŁżŔÁ䊝ČŃÇüŠŐĽŔÁäšşëńŞôńŞÜňî╗šľŚňüąň║ĚŠŐĽŔÁ䊝║Š×äŔĚčŠŐĽŃÇ銜ôňç»ŔÁ䊝ČňťĘŠťČŠČíń║ĄŠśôńŞşŠőůń╗╗ÚŽľňŞşŔ┤óňŐíÚíżÚŚ«´╝îňĄÜš╗┤ŠÁĚŠőô´╝îÚŤůŠ│ĽŔÁ䊝Ȋőůń╗╗ŔüöňŞşŔ┤óňŐíÚíżÚŚ«ŃÇ銝ČŔŻ«Ŕ׏ŔÁäŠëÇňőčÚŤćŔÁäÚçĹň░ćńŞ╗ŔŽüšöĘń║ÄňŐáň┐źŠľ░ňćášľźŔőŚńŞ┤ň║ŐšáöšęÂŃÇüGMPšöčń║žŔŻŽÚŚ┤šÜäň╗║Ŕ«żŃÇüń╗ąňĆŐŠëęňůůšáöňĆĹš«íš║┐ŃÇ銾»ňż«šöčšëę´╝łStemirna´╝ëń║Ä2016ň╣┤ňťĘńŞŐŠÁĚň╝áŠ▒芳ɚźő´╝îšö▒šżÄňŤŻMD AndersonŔé┐šśĄńŞşň┐âšÜäňŹÜňúźňŤóÚśčňŻĺňŤŻňłŤň╗║´╝»šŤ«ňëŹňŤŻňćůÚóćňůłšÜämRNAšľźŔőŚń╝üńŞÜŃÇéňůŠáŞň┐âŠŐÇŠť»ňîůŠőČ´╝Ü´╝ł1´╝ëmRNAňÉłŠłÉň╣│ňĆ░´╝îIVT-mRNAŠś»ńŞÇšžŹňłęšöĘDNAŠĘ튣┐ňťĘńŻôňĄľňÉłŠłÉmRNAšÜäńŞÇšžŹŠľ░ň×őŠŐÇŠť»´╝Ť´╝ł2´╝ëLPP (lipopolyplex) š║│š▒│ÚÇĺÚÇüň╣│ňĆ░´╝»Š»öń╝áš╗čšÜäLNPšŤŞŠ»öňůĚŠťëŠŤ┤ňąŻšÜäňîůŔŻŻŃÇüń┐ŁŠŐĄmRNAšÜ䊼łŠ×ť´╝îň╣ÂŔâŻňĄčÚÜĆŔüÜňÉłšëęšÜäÚÖŹŔžúÚÇÉŠşąÚçŐŠöżmRNAňłćňşÉšÜäŠŐÇŠť»ň╣│ňĆ░ŃÇé
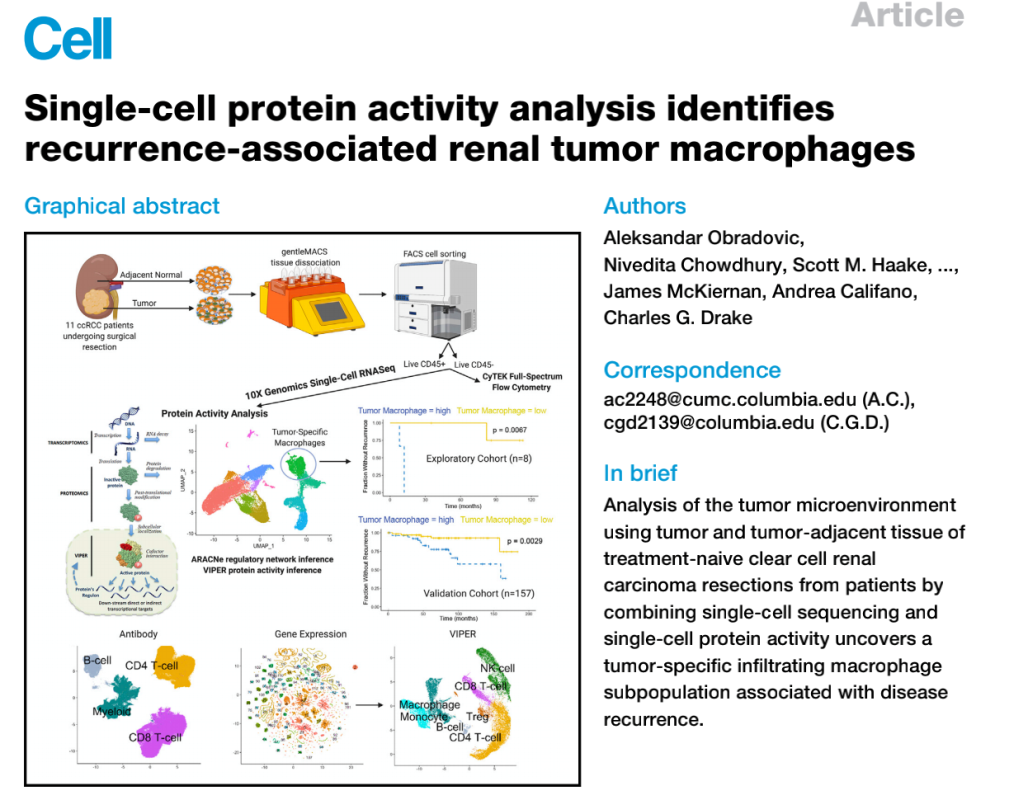
ńŞëŃÇüňŹĽš╗ćŔâ×ŔŤőšÖŻŠ┤╗ŠÇžňłćŠ×ÉŠĆşšĄ║ńŞÄŔéżšÖîňĄŹňĆĹšŤŞňů│šÜäňĚĘňÖČš╗ćŔâ×
ŠťČš»çŠś»ŠŁąŔç¬ňôąń╝ŽŠ»öń║ÜňĄžňşŽŠČžŠľçňî╗ňşŽńŞşň┐âšÜäCharles G. DrakeňŤóÚśčňĆĹŔíĘšÜäArticleŠľçšźáŃÇéŔéżÚÇĆŠśÄš╗ćŔâךÖî´╝łccRCC´╝늜»ńŞÇšžŹň╝éŔ┤ĘŠÇžšľżšŚů´╝îňůŠť»ňÉÄšŚůšĘőňĆ»ňĆśŃÇéńŞ║ń║ćš╗äŔúůňůĘÚŁóšÜäÚÇĆŠśÄš╗ćŔâ×ŔéżšÖî´╝łccRCC´╝ëŔé┐šśĄňż«šÄ»ňóâňŤżŔ░▒´╝îšáöšęÂń║║ňĹśň»╣ŠŁąŔ笊ť¬š╗ĆŠ▓╗šľŚšÜäccRCCňłçÚÖĄŠť»šÜäŔé┐šśĄňĺîÚé╗Ŕ┐ĹŔé┐šśĄš╗äš╗çšÜäÚÇáŔíÇňĺîÚŁ×ÚÇáŔíÇń║ÜšżĄŔ┐ŤŔíîń║ćňŹĽš╗ćŔâ×RNAŠÁőň║Ć´╝łscRNA-seq´╝ëŃÇéšáöšęÂń║║ňĹśňłęšöĘVIPERš«ŚŠ│Ľň»╣ňŹĽš╗ćŔâ×ŔŤőšÖŻŔ┤ĘŠ┤╗ŠÇžŔ┐ŤŔíîň«ÜÚçĆ´╝îň╣ÂÚÇÜŔ┐çńŞÄŠÁüň╝Ćš╗ćŔâ׊ť»Ŕ┐ŤŔíöŔżâÚ¬îŔ»üń║ćŔ»ąŠľ╣Š│ĽŃÇéŔ»ąňłćŠ×Éší«ň«Üń║ćňů│Úö«šÜäTMEń║ÜšżĄňĆŐňůÂńŞ╗ŔŽüŔ░âŠÄžňŤáňşÉňĺîňÇÖÚÇëš╗ćŔâ×ń╣őÚŚ┤šÜ䚍Şń║ĺńŻťšöĘ´╝îń╗ÄŔÇîŠĆşšĄ║ń║抌áŠ│ĽÚÇÜŔ┐çňč║ňŤáŔíĘŔżżňłćŠ×ÉŠúÇŠÁőňł░šÜäńŞ┤ň║ŐšŤŞňů│ń║║šżĄŃÇéňůĚńŻôŠŁąŔ»┤´╝îšáöšęÂń║║ňĹśňĆĹšÄ░ń║ćń╗ąTREM2/APOE/C1QńŞŐŔ░âńŞ║šë╣ňżüšÜäŔé┐šśĄšë╣ň╝éŠÇžňĚĘňÖČš╗ćŔâ×ń║ÜšżĄ´╝îň╣ÂÚÇÜŔ┐çšę║ÚŚ┤ňłćŔżĘŃÇüň«ÜÚçĆňĄÜňůëŔ░▒ňůŹšľźŔŹžňůëŔ┐ŤŔíîÚ¬îŔ»üŃÇéňťĘňĄžň×őńŞ┤ň║ŐÚ¬îŔ»üÚśčňłŚńŞş´╝îŔ┐Öń║ŤŠáçň┐ŚšëęňťĘŠëőŠť»ňÉÄňĄŹňĆĹšÜäŠéúŔÇůšÜäŔé┐šśĄńŞşŠśżŔĹŚńŞ░ň»îŃÇéňŤáŠşĄ´╝îŔ»ąšáöšęší«ň«Üń║ćTREM2/APOE/C1QÚś│ŠÇžňĚĘňÖČš╗ćŔâ׊ÁŞŠÂŽŠś»ccRCCňĄŹňĆĹšÜ䊯ťňťĘÚóäňÉÄšöčšëęŠáçň┐Śšëę´╝îń╣芜»ňÇÖÚÇëšÜäŠ▓╗šľŚÚŁÂŠáçŃÇé´╝łŠĹśŔŽü´╝ë
´╝łňÄ芾çÚôżŠÄą´╝Ühttps://doi.org/10.1016/j.cell.2021.04.038´╝ë┬á
ňŤŤŃÇüÚÇÜŔ┐çŠŐĹňłÂň묊ĹńŻôŠŹĽŔÄĚňĺîš╗┤Šîüň░ĆÚ╝áňůĘŔâŻň╣▓š╗ćŔâ×
ŠťČš»çŠś»ŠŁąŔç¬ňîŚń║ČňĄžňşŽšÜ䊣ťÚ╣ĆŠĽÖŠÄłňŤóÚśčňĆĹŔíĘšÜäArticleŃÇéŔç¬ň╗║šźőšČČńŞÇŠá¬ŔâÜŔâÄň╣▓š╗ćŔâ×´╝łESC´╝ëń╗ąŠŁą´╝îň«×šÄ░ňťĘňŐčŔâŻňĺîňłćňşÉńŞŐńŞÄńŻôňćůňŹÁŔúéšÉ⚍ŞňŻôšÜäňůĘŔ⯚╗ćŔâ×ńŻôňĄľňč╣ňů╗ń╗ŹňůĚŠťëňĚĘňĄžŠîĹŠłśŠÇžŃÇéšáöšęÂń║║ňĹśňĆĹšÄ░´╝îň░ĆÚ╝áŔâÜŔâÄň╣▓š╗ćŔâ×´╝łESC´╝ëň묊ĹńŻôŠŐĹňłÂŔâŻňĄčÚę▒ňŐĘňĄÜŔâŻňł░ňůĘŔ⯚ŐŠÇüšÜäŔŻČŠŹóŃÇéńŻ┐šöĘň묊ĹŠŐĹňłÂňëéPladienolide B´╝îšáöšęÂń║║ňĹśňĆ»ń╗ąňťĘňůĘŔ⯚ÜäESCńŞŐň«×šÄ░šĘ│ň«ÜšÜäńŻôňĄľňč╣ňů╗´╝îŔ┐ÖňťĘňłćňşÉŠ░┤ň╣│ńŞŐńŞÄ2š╗ćŔâ×ňĺî4š╗ćŔâ×ňŹÁŔúéšÉâ´╝łŔóźšž░ńŞ║ňůĘňŹÁŔúéňŹÁšÉâŠáĚš╗ćŔâ×TBLC´╝뚍Şň¬▓šżÄŃÇéň░ĆÚ╝áňÁîňÉłŠúÇŠÁőńŞÄňŹĽš╗ćŔâ×RNAŠÁőň║Ć´╝łscRNA-seq´╝ëš╗ôňÉłŔíĘŠśÄTBLCňůĚŠťëň╝║ňĄžšÜäňĆîňÉĹňĆĹŔé▓ŔâŻňŐŤ´╝îňĆ»ń║žšöčňĄÜšžŹŔâÜŔâÄňĺîŔâÜňĄľš╗ćŔâ×Ŕ░▒š│╗ŃÇéňťĘŠť║ňłÂńŞŐ´╝îň묊ĹńŻôŠŐĹňłÂň»╝Ŕç┤ňĄÜŔâŻňč║ňŤášÜäň╣┐Š│Ťň묊ĹŠŐĹňłÂ´╝îŔÇîňçáń╣ÄńŞŹňÉźščşňćůňÉźňşÉšÜäňůĘŔâŻňč║ňŤáŔ󟊝늼łň묊Ĺň╣ÂŔŻČňŻĽŠ┐ÇŠ┤╗ŃÇéŔ┐ÖÚí╣šáöšęŠĆÉńżŤń║ćńŞÇšžŹŠŹĽŔÄĚňĺîš╗┤ŠîüňůĘŔâŻň╣▓š╗ćŔâךÜ䊾╣Š│ĽŃÇé´╝łŠĹśŔŽü´╝ë
´╝łňÄ芾çÚôżŠÄą´╝Ühttps://doi.org/10.1016/j.cell.2021.04.020´╝ë