2023年是FDA现代化法案2.0(The FDA Modernization Act 2.0)实行的首个完整年度。法案的一大变化在于取消了临床前试验必须使用动物的规定,取而代之的是非临床测试和试验 (nonclinical tests and studies)。自此,延续80多年的医药研发流程将被颠覆。
这一方案得到了共和党和民主党的广泛支持,取得了392:28的压倒性投票结果。提出该法案的Kentucky议员Rand Paul表示:“The FDA Modernization Act 2.0will accelerate innovation and get safer, more effective drugs to market more quickly by cutting red tape that is not supported by current science.”
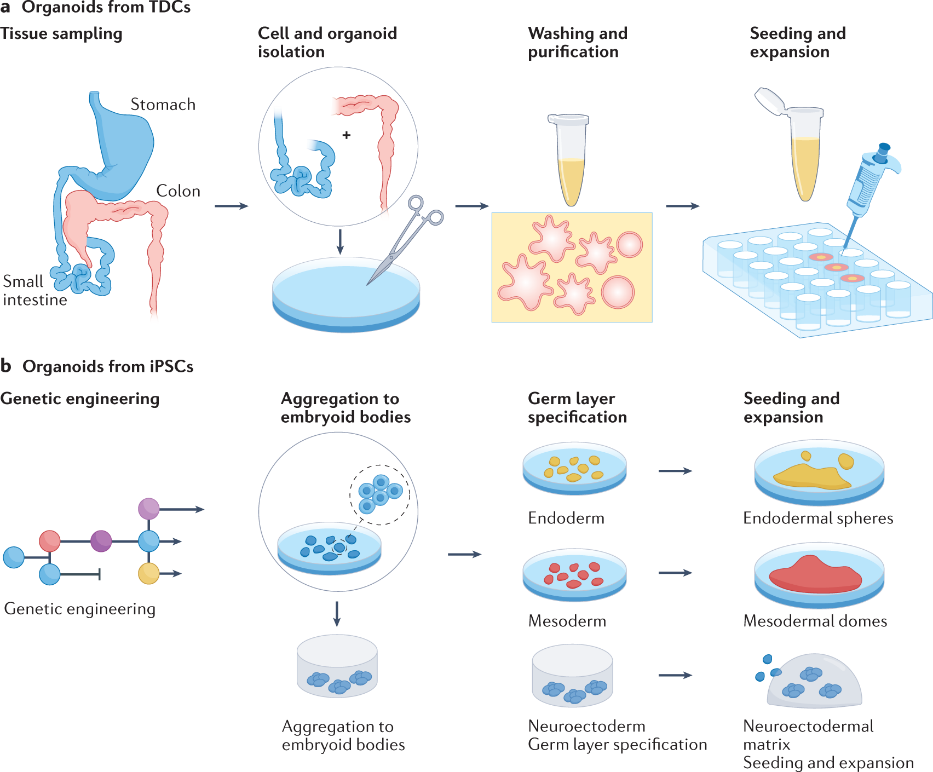
类器官(Organoid)是由干细胞(多能、成体干细胞)在体外3D培养下通过增殖、分化和自我组织形成的微观三维结构,与原生组织在细胞类型、结构及功能上相似。类器官拥有自我更新能力,维持了来源组织的生理结构和功能特点,拥有“培养皿中的微器官”之称。
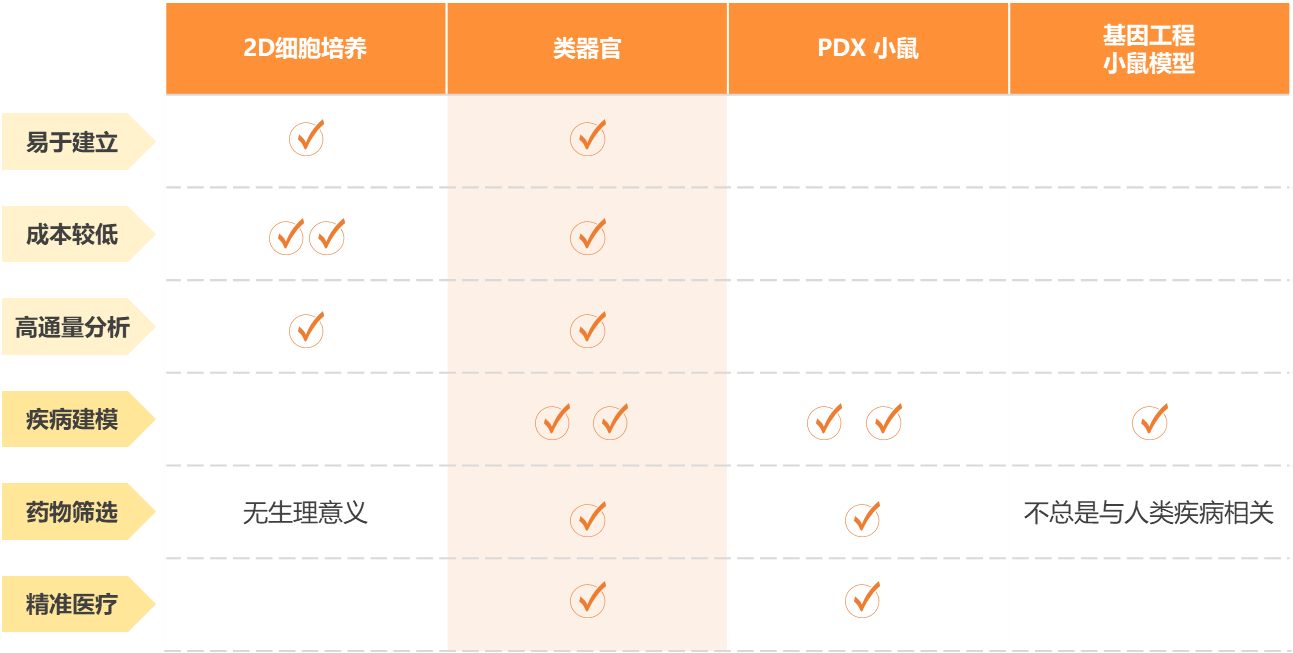
传统动物模型如小鼠,由于种属差异,在细胞、遗传、免疫水平及药代动力学等方面差异巨大,导致对实际人体反应预测能力较差。而非人灵长类动物价格昂贵、且难以进行高通量筛选,应用受限。
类器官优势在于(1)人源性:代表了部分人体生理;(2)培养迅速:来自于人成体干细胞和多能干细胞的类器官可以迅速、容易获得,一般培养一周之后就可以进行药筛;(3)高通量:性质稳定,可在孔板上进行大规模基因组筛查和药物筛选;(4)可遗传操控:大多数现代基因工程工具可应用于诱导多能干细胞或直接应用于类器官系统;(5)个体化:类器官可以从个体获得,研究结果可直接对应到个体信息。
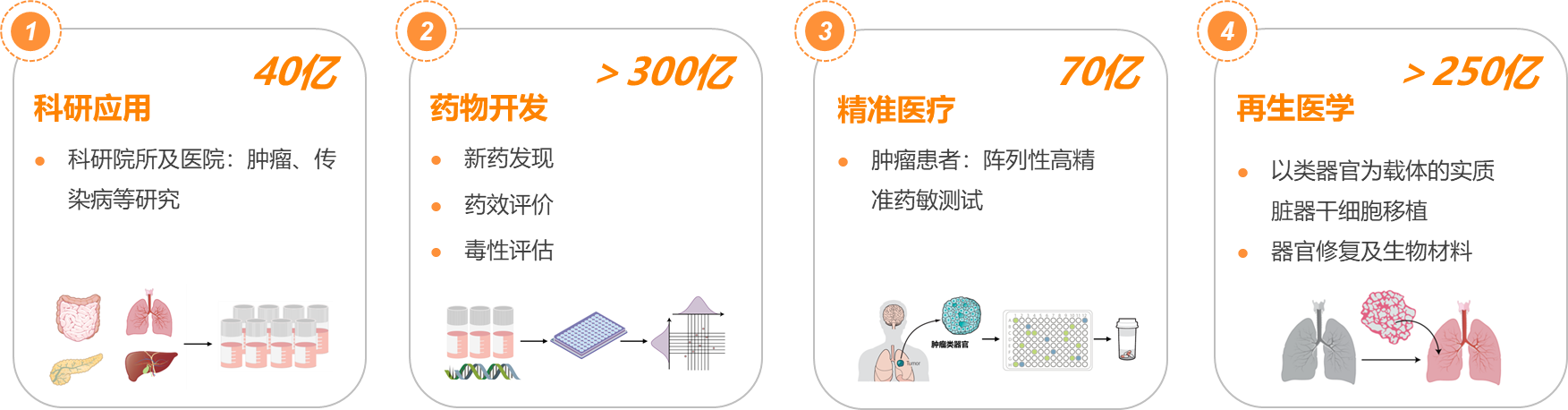
2013年,类器官被Science评为年度十大技术。2018年初,类器官被Nature Method评为2017年度最佳方法。类器官相关文章2015年仅有270篇见刊,7年间迅速增长突破3,000篇。目前,多种脏器类器官已被成功构建,其中包括小肠、胃、结肠、肺、膀胱、大脑、肝脏、胰腺、肾脏、卵巢、食道、心脏等,不仅包括正常器官组织类器官,还有相应肿瘤组织类器官。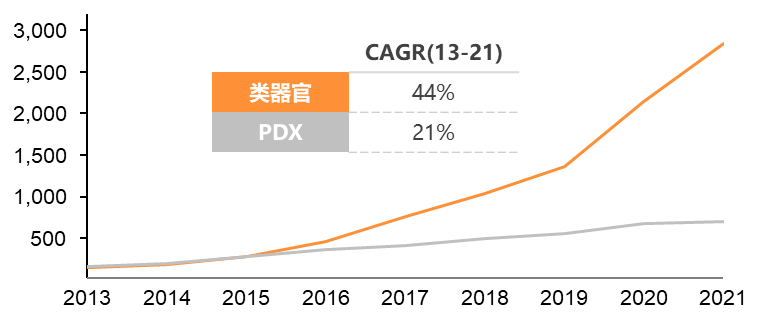 1.2 药物开发类器官集相似性强、高通量等优势,可应用于药物筛选、药效评价、毒性评估等。2022年,赛诺菲与Hesperos合作研发的新药进入临床试验(NCT04658472),其临床前数据完全基于类器官技术。
1.2 药物开发类器官集相似性强、高通量等优势,可应用于药物筛选、药效评价、毒性评估等。2022年,赛诺菲与Hesperos合作研发的新药进入临床试验(NCT04658472),其临床前数据完全基于类器官技术。
类器官已经用于适应症拓展方向。由于已获批药物的毒理学数据完善,其有效性可以通过类器官验证,迅速推入临床试验阶段。据悉,国内某知名医药上市公司通过建立宫颈癌类器官模型,体外评测O药和测试药物的有效性,将一款PD-1药物适应症从肺癌扩展到宫颈癌,并成功获批上市。
患者来源的肿瘤类器官的表型和基因型分析显示与原发患者肿瘤高度相似,在用药指导方面已得到验证。
2018年,《Science》杂志上发表了研究结果,在预测抗癌药物的有效性和指导临床用药方面,与患者实际疗效进行对比,类器官达到了100%敏感性、93%特异性、88%阳性预测值以及100%阴性预测值。
2019年,《Science Translational Medicine》发表研究结果,类器官在药物筛选的结果与临床病人的药效结果一致性能够超过80%,明显优于以往不到30%的结果一致性。
2020年,《Cell Stem Cell》发表研究结果, III期临床试验的局部晚期直肠癌患者放化疗反应与与相应的类器官反应高度匹配,准确率达84.43%,敏感性达78.01%,特异性达91.97%。
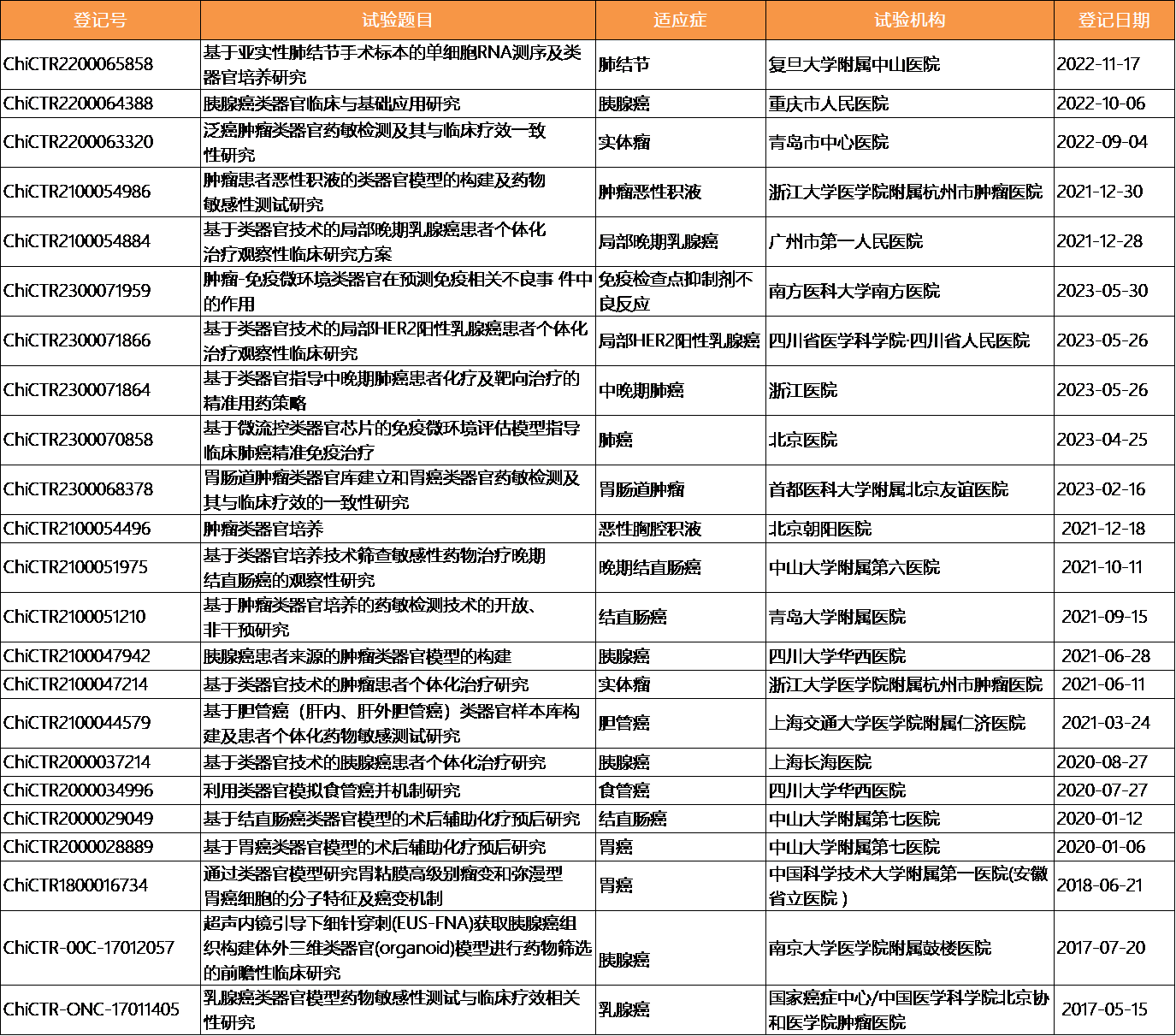
器官移植一直面临移植器官短缺、身体免疫排异反应及系列伦理问题。类器官具有组织修复的潜力,可以说是体外培养器官的微型版和简化版,基于自体细胞产生的类器官有希望降低触发免疫排异反应的概率。
2021年,剑桥大学团队在《Sciences》上发表研究表明,胆管类器官通过环境外在刺激恢复细胞多样性,类器官移植到胆管受到化学损伤的小鼠体内,能和不同部位的胆管结合再生受损组织,小鼠顺利存活。在三个不达移植标准的供肝中,也显示在移植相应的类器官后肝的受损管道恢复了功能。
2.厚积薄发 未来已来
类器官源自于干细胞及发育生物学研究,2000年初干细胞相关研究如iPSC,使得培养微型器官理论基础逐渐完备,转折点来自Hans Clevers团队的成果。
2009年,Hans Clevers团队将来自小鼠肠道的Lgr5+肠道成体干细胞添加Wnt信号通路激动剂R-spondin、TGF-β抑制剂Noggin、表皮生长因子等干细胞必要生长因子,成功培养出小肠类器官,并且具有肠隐窝-绒毛结构。跨时代的改变在于建立了可复制的类器官培养系统。
在此之后,通过调整生长因子、修改细胞分离流程,胃肠道、食管、肝脏、胰腺、脑、肺、前列腺、乳腺、皮肤、肾脏、心脏、味蕾、唾液腺、角膜等多种类器官模型陆续成功构建。类器官进入现代化阶段。
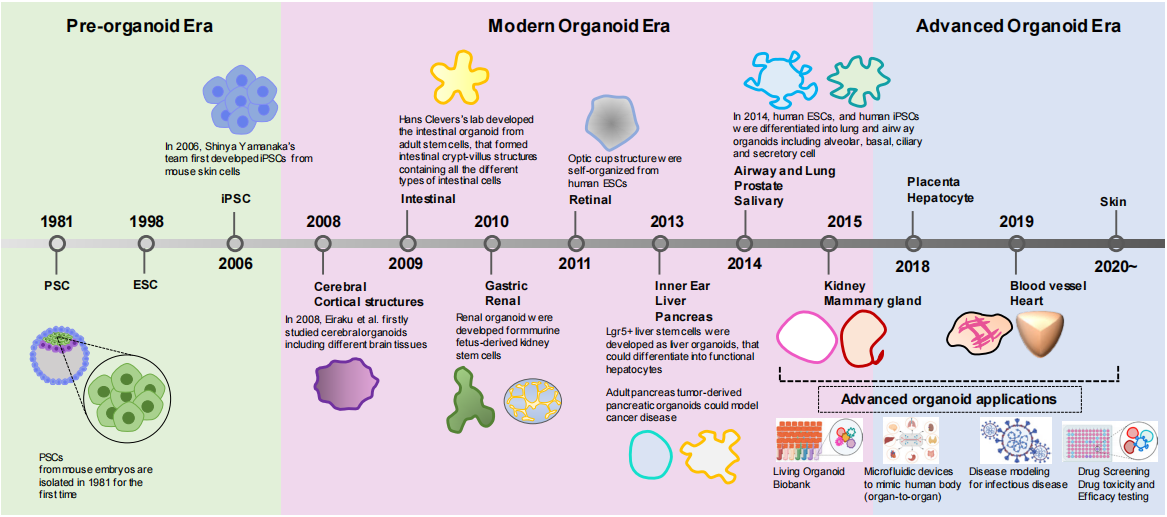
随后,类器官逐渐进入药物研发等应用领域。2015年,Hans Clevers团队构建了患者来源的结直肠癌类器官,进行了小规模药物敏感性筛选,提示类器官技术可以填补癌症遗传学和患者试验之间的空白,对于药物研发模型来说是一个很好的补充,并可以针对个体患者设计个性化的治疗方案。
2.1 政策加速产业落地
随着类器官潜力逐渐被发掘,政策也及时作出了调整,支持类器官在医药研发中发挥关键作用。
2019年,积极推动包括类器官在内的体外工程化微系统应用于药物临床前研究。
2021年,鼓励类器官作为儿童肿瘤模型。FDA肿瘤卓越中心发文,对于大多数儿童肿瘤的研究和药物开发,由于缺乏研究模型,鼓励利用患者来源的异种移植模型、类器官模型开展研究。
2022年,FDA现代化法案2.0通过,Alternative Methods Working Group建立,以讨论全新的体外、体内研究方法。
2021年底CDE(国家药品监督管理局药品审评中心)首次将类器官列入CGT产品的药理学、有效性和安全性评估当中。
其中《基因治疗及针对基因修饰细胞治疗产品的指导原则(试行)》指出,针对基因修饰细胞治疗产品“当缺少相关动物模型时,可采用基于细胞和组织的模型(如二维或三维组织模型、类器官和微流体模型等)为有效性和安全性的评估提供有用的补充信息”。
《基因治疗产品非临床研究与评价技术指导原则(试行)》指出,“由于种属和免疫状态的差异,基因治疗产品在人体内的表达、分布和作用与在模型动物中可能有较大不同,可选用替代产品(如治疗基因使用来自模型动物的同源基因,或使用基因修饰的模型动物细胞、组织和类器官等)进行 POC研究。”
国内相关标准不断完善,如《人胃肠道上皮与肿瘤类器官标准操作指南团体标准》、《人员肺癌类器官培养技术规范》、《类器官药物敏感性检测指导肿瘤精准治疗临床应用专家共识(2022年版)》、《肿瘤类器官诊治平台的质量控制标准中国专家共识(2022年版)》等,这一系列行业共识将加速类器官技术在新药研发领域作为标准化评价模型,提供国家药审部门认可数据的进程。
类器官相关企业近年来发生多笔并购、融资事件,Emulate和 Xilis的融资不断推动着行业走向融资新高峰。Emulate至今融资总额已超2.2亿美元。
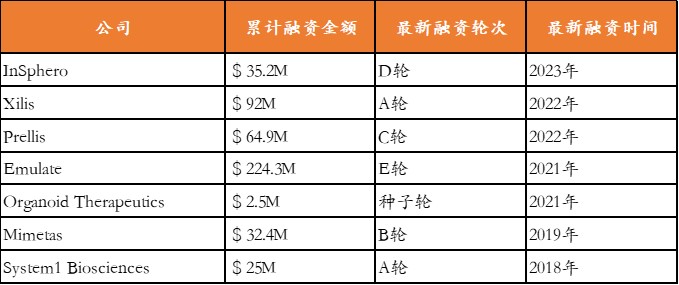
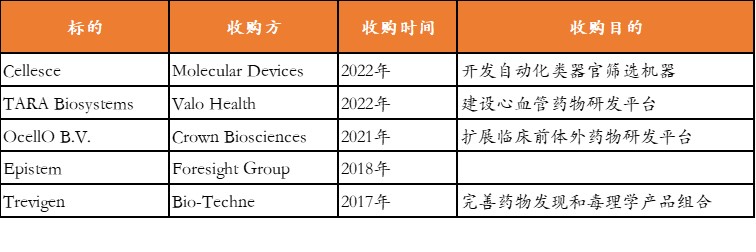
生命科学巨头通过并购或合作方式切入类器官赛道。强生、阿斯利康、辉瑞等,从2015年开始陆陆续续与类器官公司建立合作,将类器官整合进内部实验室。
此外,由艾伯维、默克、诺华等20余家TOP药企共同成立非营利组织IQ联盟(Innovationand Quality Consortium),致力于推动类器官技术的标准化应用,以加速药物研发进程。
2022年3月,“国际类器官鼻祖”Hans Clevers正式成为罗氏制药Research and Early Development部门的负责人,专注于利用类器官更好地预测候选药物的安全性和有效性。
3.根深蒂固 枝繁叶茂
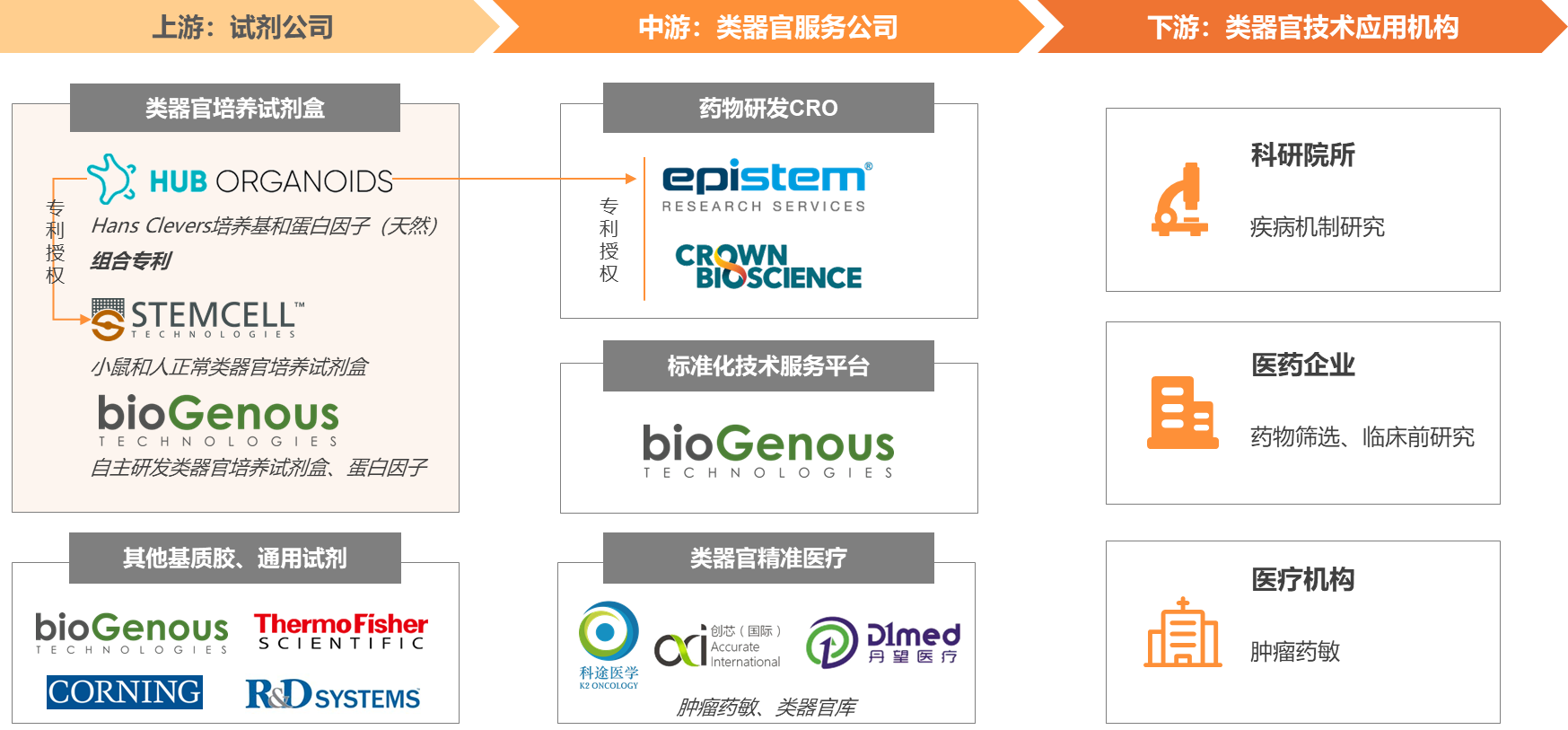
类器官上游以试剂耗材企业为主,相关自动化设备企业多处于研发阶段。
类器官制备需用到组织运输保存液、组织消化液、红细胞裂解液、基质胶、润洗液、类器官消化液、基础培养基、类器官冻存液、生长因子等试剂,从流程上可分为组织酶解试剂盒、类器官培养试剂盒、扩增试剂盒、冻存复苏试剂盒。
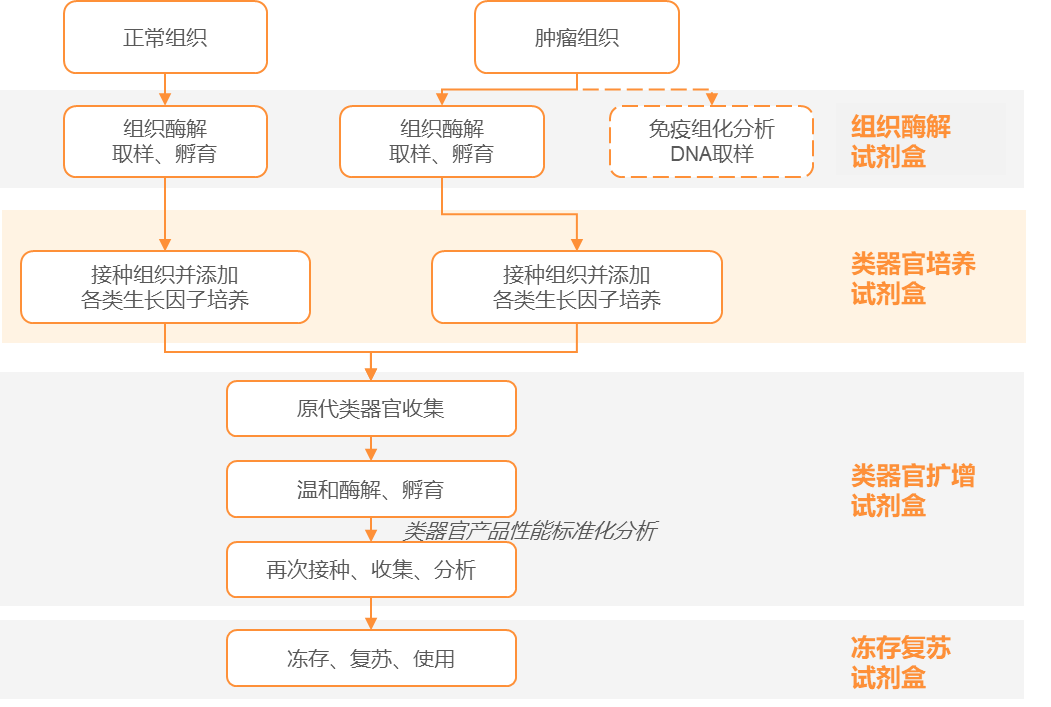
在类器官发展历史中,Hans Clevers团队对于类器官生长因子研究起到了至关重要的作用,这是类器官能够稳定培养的关键。类器官培养试剂盒的核心作用是保持细胞干性,抑制细胞分化,促进细胞自我更新。包含高活性生长因子的类器官培养试剂是流程的重中之重。
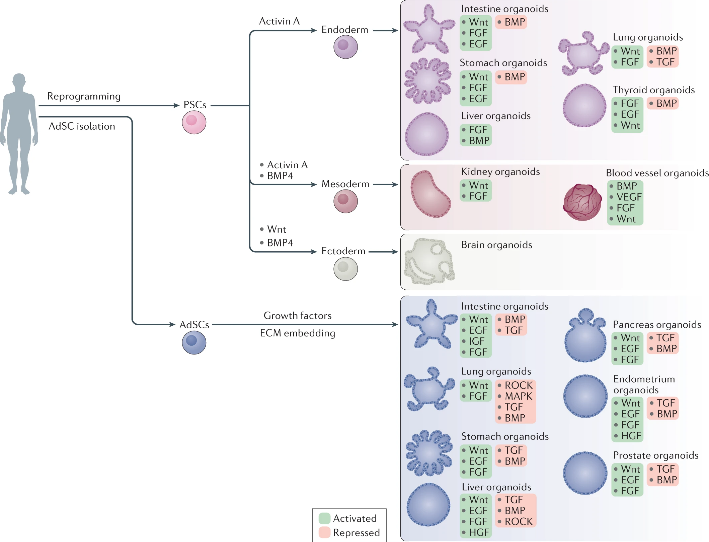
在Hans Clevers之后,大量的研究尝试了不同的生长因子组合。这些组合,Wnt、BMPi、EGF是必不可缺的生长因子组合,意味着这三者是能够有稳定、良好培养效果的最小试剂组合。由于三种生长因子均为天然蛋白,无法直接做蛋白的专利保护,因此Hans Clevers对这一最小组合(商用场景)进行了严密的专利保护。这些发明作为Hans Clevers的职务发明,可供Hubrecht Organioid Technology(HUB)这一研究机构对外授权使用。2014年,STEMCELL Technology与HUB签署了许可协议,成为其类器官培养试剂的独家供应商。
在此之外,国产公司伯桢生物另辟蹊径,脱离Hans Clevers技术体系,提供全自主知识产权的培养试剂。伯桢生物基于发育生物学、结构生物学研究,解析发育图谱及组织微环境,发现新的培养调控通路;结合蛋白质工具进化平台,打造了全新的生长因子。基于伯桢试剂的类器官文章已发表在《Cell Stem Cell》、《Nature Communications》、《Cell Research》等权威期刊。

因此,在关键的类器官领域,形成了相对垄断的局面,GMP级供应商仅有STEMCELL Technology(HUB授权)与伯桢生物(新的培养调控通路,人工设计蛋白)。
类器官中游为提供类器官技术服务的企业,下游主要包括医药企业、CRO、科研院所、医院等。中游企业通过相对标准化的产品和服务,将类器官这一创新技术,形成细分的解决方案提供给下游。下游客户由于研发效率、精准诊疗等需求,积极与中游企业互动,常常形成联合开发的关系,促进了应用转化。
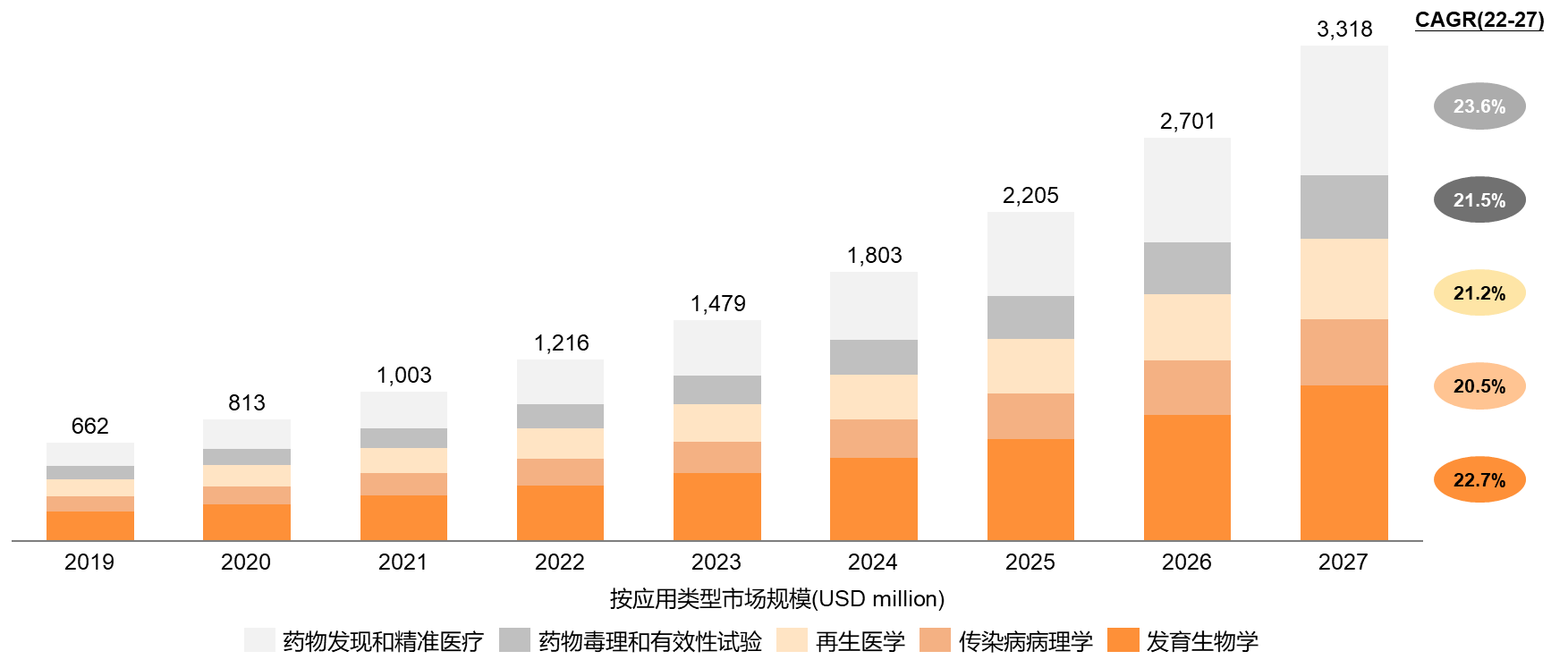
据BCC Research估算,2027年全球类器官市场规模将达33亿美元。在产业发展初期,发育生物学作为类器官的引擎和主战场,占据近30%市场份额。药物发现和精准医疗将是未来五年增速最快的细分市场。
自2015年开始,类器官从象牙塔走向产业,类器官企业多带有明确的科研团队色彩,例如Emulate来自哈佛大学,Hesperos来自康奈尔大学,Xilis 则由Hans Clevers联合创立。国内,伯桢生物来自复旦大学类器官中心,丹望医疗来自复旦大学医学院,创芯国际来自澳门大学。未来类器官从科研工具向生物医药基础工具发展,仍有不少挑战需要解决。
(1)标准化:类器官尚缺乏标准的制备流程和体系,各谱系和癌种的培养方法和结果千差万别,未来依赖于中下游企业在互动中形成细分解决方案和标准。
(2)高通量:高通量依赖于自动化设备的支持,包括自动化工作站、微流控、精密仪器等技术。自动化实现的关键在于建立标准化培养体系、解决类器官脆弱小尺寸等技术难点。
(3)多技术结合:结合高内涵成像、AI等跨学科方法可进一步提升通量,提高可靠性稳定性。另外,将CRISPR技术与类器官相结合,能够实现精准研究单一基因突变对细胞的影响,从而建立起基因型和表型的关联性。如现罗氏制药研究和早期开发部门负责人Hans Clevers的团队最近在杂志《Nature Biotechnology》上发表的研究,即是利用APOB和MTTP突变类器官建立了一个基于CRISPR的筛选平台,以识别脂肪变性调节剂/靶点,并评估NAFLD风险基因。
(4)合规化:类器官下游应用需要全流程的合规化,例如GMP级试剂、人源类器官的伦理合规、类器官库商用合规、新型医疗技术入院等。其中,类器官的人遗属性备受关注。作为原代细胞或组织的衍生物,类器官是否属于人类遗传资源材料仍不明确,具体的管理规定正在逐步完善。
4.国内相关公司
伯桢生物成立于2021年,提供国内唯一自主知识产权试剂+设备类器官解决方案,实现上游平台体系全闭环。公司创始团队来自复旦大学类器官中心,团队深耕类器官应用超十年,构建全球首例人源类器官新冠感染模型。类器官培养试剂方面,基于类器官体系开发、蛋白质工具进化平台,突破类器官技术上游封锁,并具备GMP级生产能力;发布国际首台首制的自动化工作站,用于高通量类器官培养及药物筛选。目前已完成近亿元A轮融资。
科途医学创立于2016年,是专注于类器官技术研发与商业转化的企业。目前拥有研发中心,临床医学检验所及GMP级细胞培养生产基地和实验动物基地。30余个发明专利、肿瘤类器官疾病模型库以及类器官培养全流程产品。可为生物医学科学研究、药物研发和临床精准医疗提供标准化专业类器官产品和技术服务。目前已完成数千万元B轮融资。
创芯国际成立于2018年,是一家以类器官技术为核心的创新型生物医疗企业,下设中欧类器官研究院、第三方医学检验所与类器官研发技术平台。创芯国际致力于临床个体化治疗、新药研发及再生医学三个方向,拥有完整的类器官产业链,在北京、广州、上海、澳门和意大利米兰分别设立了研发中心,同时与全国超过60家核心医院开展了临床及科研合作,在10个核心城市建立实验室。目前已完成1亿元Pre-B轮融资。
丹望医疗成立于2019年,是一家定位全球的生物医药公司。丹望医疗致力于将领先的类器官技术用于临床转化,包括对疾病的诊疗、新药筛选、肿瘤标志物开发与鉴定,为临床患者提供个性化的精准治疗方案,同时为药企提供“一站式”精准、高效、优质的类器官新药研发服务,是专注类器官疾病模型的平台型公司。创始人华国强博士深耕类器官技术十余年,具有丰富的疾病模型建立和药物研发临床前开发经验。目前已完成过亿元A轮融资。
参考资料:
1. Li Y, Tang P, Cai S, Peng J, Hua G. Organoid based personalized medicine: from bench to bedside. Cell Regen. 2020;9(1):21. doi:10.1186/s13619-020-00059-z
2. Intra-tumour diversification in colorectal cancer at the single-cell level | Nature. Accessed June 27, 2023. https://www.nature.com/articles/s41586-018-0024-3
3. Vlachogiannis G, Hedayat S, Vatsiou A, et al. Patient-derived organoids model treatment response of metastatic gastrointestinal cancers. Science. 2018;359(6378):920-926. doi:10.1126/science.aao2774
4. Cholangiocyte organoids can repair bile ducts after transplantation in the human liver | Science. Accessed June 29, 2023.
5. van de Wetering M, Francies HE, Francis JM, et al. Prospective derivation of a Living Organoid Biobank of colorectal cancer patients. Cell. 2015;161(4):933-945. doi:10.1016/j.cell.2015.03.053
6. Park SE, Georgescu A, Huh D. Organoids-on-a-chip. Science. 2019;364(6444):960-965. doi:10.1126/science.aaw7894
7. Zhou Z, Van der Jeught K, Fang Y, et al. An organoid-based screen for epigenetic inhibitors that stimulate antigen presentation and potentiate T-cell-mediated cytotoxicity. Nat Biomed Eng. 2021;5(11):1320-1335. doi:10.1038/s41551-021-00805-x



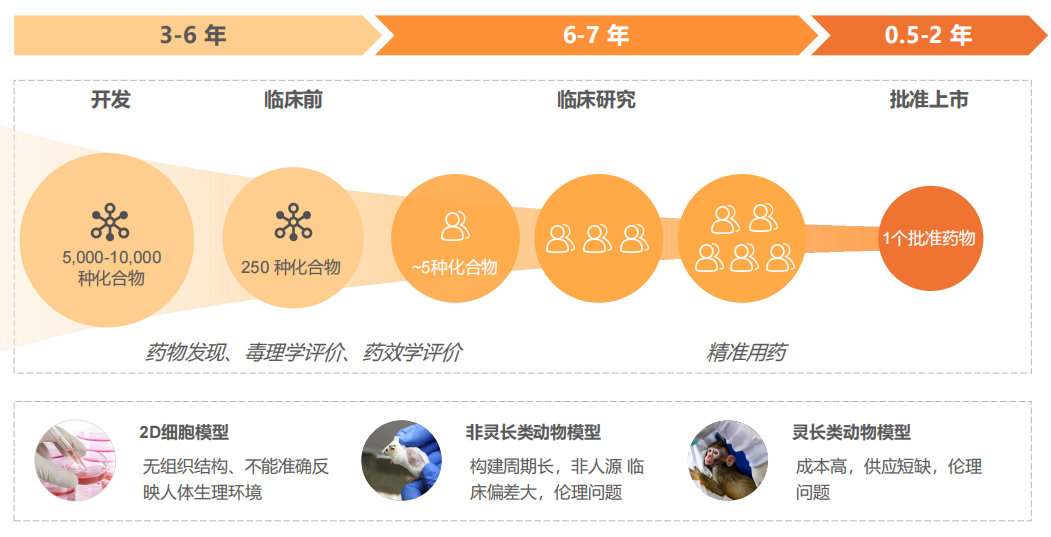
 1.2 药物开发类器官集相似性强、高通量等优势,可应用于药物筛选、药效评价、毒性评估等。2022年,赛诺菲与Hesperos合作研发的新药进入临床试验(NCT04658472),其临床前数据完全基于类器官技术。
1.2 药物开发类器官集相似性强、高通量等优势,可应用于药物筛选、药效评价、毒性评估等。2022年,赛诺菲与Hesperos合作研发的新药进入临床试验(NCT04658472),其临床前数据完全基于类器官技术。










