

ňč║ń║ÄŠłĹňŤŻńŻťńŞ║Ŕ飚ÖîňĄžňŤŻšÜäšÄ░šŐ´╝îŔ飚ÖîšÜäń╗őňůąŠ▓╗šľŚŠś»šŤ«ň돊áôňí×ňż«šÉ⊝NJłÉšćčšÜäň║öšöĘňť║ŠÖ»ŃÇ銏«š╗čŔ«í´╝ĹňŤŻ2020ň╣┤Ŕ飚Ö░ňĆĹ41ńŞç´╝îŠÄĺňÉŹšČČ5´╝îňŹáňůĘšÉ⊻öńżőŔÂů45%´╝ŤŠş╗ń║íń║║ŠĽ░39ńŞç´╝îŠÄĺňÉŹšČČ2´╝îňŹáňůĘšÉ⊻öńżő47%ŃÇ銳ĹňŤŻňĺîňůĘšÉâŔîâňŤ┤ňćů´╝îňů▒ňÉîňĹłšÄ░ňç║Šş╗ń║íń║║ŠĽ░Ŕ┐ŻŔÁŠľ░ňĆĹń║║ŠĽ░šÜäŔÂőňŐ┐´╝îŔ┐Öń╣čŠäĆňĹ│šŁÇŠéúŔÇůÚŁóńŞ┤šÜäšľżšŚůŠâůňćÁŠäłňĆĹńŞąň│╗´╝îŠëęň▒ĽŠ▓╗šľŚš¬ŚňĆúŠťčńżŁšäŠś»Ŕë░ňĚĘšÜäÚĽ┐Šťčń╗╗ňŐíŃÇé
ňĄľšžĹŠëőŠť»Š▓╗šľŚÚĺłň»╣ŔŻČšž╗ŠÇžŔ飚ÖîňĆŐńŞŹňĆ»ňłçÚÖĄŔ飚ÖłŠ×ťŠťëÚÖÉ´╝îŔÇîňťĘŔŹ»šëęŠ▓╗šľŚÚóćňčč´╝îFDAňĺîNMPAňůłňÉÄń║ÄňÄ╗ň╣┤5Šťłňĺî10ŠťłŠë╣ňçćń║ćÚś┐ŠŤ┐ňłęšĆáňŹĽŠŐŚŔüöňÉłŔ┤Łń╝ÉšĆáňŹĽŠŐŚšöĘń║ÄŠť¬ŠŤżŠÄąňĆŚŔ┐çš│╗š╗čŠ▓╗šľŚšÜäńŞŹňĆ»ňłçÚÖĄŔ飚ÖîŠéúŔÇů´╝îń╣芜»šÄ░ڜŠ«ÁňůĘšÉâŔîâňŤ┤ňćůňö»ńŞÇńŞÇńެŔÄĚŠë╣šÜäšöĘń║ÄńŞÇš║┐Š▓╗šľŚšÜäŔé┐šśĄňůŹšľźŠľ╣Šíł´╝îŔŹ»šëęšľŚŠ│ĽšÜäÚĽ┐ŠťčŠťëŠĽłŠÇžňĺîňë»ńŻťšöĘŔ┐śÚťÇŔŽüÚÇÜŔ┐犍┤ňĄÜÚÜĆŔ«┐ŠŁąŔ»üň«×ŃÇé
ňťĘń╗őňůąŠ▓╗šľŚŠŐÇŠť»ńŞş´╝îš╗Ćň»╝š«íŔíÇš«íŠáôňí׊ť»(TACE)Šś»ÚŁ×ňŞŞÚçŹŔŽüšÜäńŞÇš▒╗ŠŐÇŠť»´╝îńŞ╗ŔŽüŠś»š╗ĆňŐĘŔä늳ľÚŁÖŔäëňćůň»╝š«íň░ćŠáôňí×ňëéŠ│Ęňůąňł░šŚůňĆśÚŁÂňÖĘň«śšÜäńżŤň║öŔíÇš«íňćů´╝îńŻ┐ŔíÇš«íňĆĹšöčÚŚşňí×´╝îńŞşŠľşŔíÇŠÂ▓ńżŤň║öŃÇéňÉ´╝îńŞ║ń║ćňŐáň╝║šľŚŠĽł´╝îň░ćÚś┐Úťëš┤ášşëňîľšľŚŔŹ»šëęń╣│ňîľňťĘšóśň▓╣ńŞş´╝îń╗ÄŔÇîŔżżňł░Šáôňí×ňĺîňîľšľŚńŞÇńŻôň▓╗šľŚšÜ䊼łŠ×ťŃÇéňťĘŠťÇŠľ░šÜäŃÇŐňÄčňĆĹŠÇžŔ飚ÖîŔ»ŐšľŚŔžäŔîâ´╝ł2019šëł´╝ëŃÇőńŞş´╝îTACEňĆ»šöĘšÜäŔîâňŤ┤ń╗ÄIbŠťčńŞÇšŤ┤Šîüš╗şňł░IIIbŠťč´╝îÚÜĆšŁÇňż«šÉâŠŐÇŠť»ňťĘšöčšëęňî╗ŔŹ»ÚóćňččšÜäŠőôň▒Ľ´╝îTACEŠŐÇŠť»šÜäŠÄĘň╣┐šÄ犝늝ŤŔ┐ŤńŞÇŠşąŠĆÉÚźśŃÇéńŞÇÚí╣Úĺłň»╣ňŤŻňćů50ňĄÜňÉŹŔé┐šśĄňĄľšžĹňî╗šöčšÜäVOCŔ░âŠčąš╗ôŠ×ťŠśżšĄ║´╝îŔÂů90%šÜäňî╗šöčÚĽ┐ŠťčšťőňąŻňůŠłÉńŞ║Šť¬ŠŁąŔ飚ÖîŠ▓╗šľŚšÜäńŞ╗ŔŽüŠľ╣ŠíłŃÇé
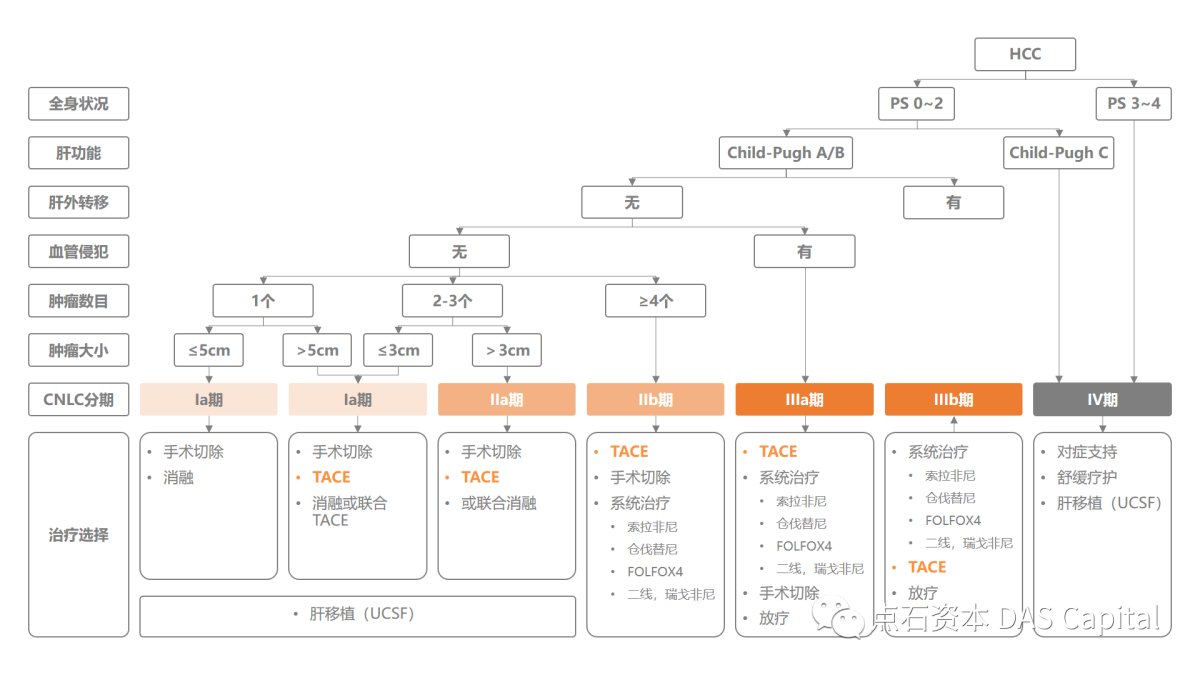
ňŤż1´╝ÜŃÇŐňÄčňĆĹŠÇžŔ飚ÖîŔ»ŐšľŚŔžäŔîâ´╝ł2019šëł)ŃÇő
ń╝áš╗čTACEŠëőŠť»ň░ćňîľšľŚŔŹ»ńŞÄšóśŠ▓╣ňůůňłćŠĚĚňÉł´╝îÚÇëšöĘŠáôňí׊ŁÉŠľÖňîůŠőČŠśÄŔâŠÁĚš╗ÁÚóŚš▓ĺŃÇüŔüÜń╣Öšâ»ÚćçÚóŚš▓ĺšşë´╝îňż«šÉâŠŐÇŠť»šÜäňç║šÄ░Š×üňĄžŔžúňć│ń║ćÔÇťŠîüń╣ůÔÇŁń┐ŁŠîüÔÇťň▒ÇÚâĘÔÇŁŠťëŠĽłŔŹ»šëęŠÁôň║ŽšÜäڝNJ▒é´╝îňÉÂń┐ŁŔ»üń║ćŔŹ»šëęÚçŐŠöżšÜäňĆ»ŠÄžŠÇžňĺîň«ëňůĘŠÇžŃÇéňůÂńŞş´╝îšę║šÖŻňż«šÉâńŻ┐ňîľšľŚŔŹ»šëęňĺîŠáôňí×ňëéŠĚĚňÉłŠŤ┤ňŁçňîÇ´╝îň«×šÄ░ň»╣ÚŁÂŔíÇš«íšÜäš▓żňçćŠáôňí×´╝ŤňĆ»ŔŻŻŔŹ»ňż«šÉâňłÖňůůňłćňłęšöĘń║ćňż«šÉâš╝ôÚçŐŠÇžšÜäń╝śňŐ┐´╝îŔ«ęŠëÇŔŻŻŔŹ»šëęňçĆň░ĹňťĘÚÇĺÚÇüŔ┐çšĘőńŞşšÜäÚçŐŠöż´╝îń┐ŁšĽÖŠŤ┤ÚźśŠÁôň║ŽŠŤ┤ÚĽ┐ŠŚÂÚŚ┤ńŻťšöĘń║ÄŔé┐šśĄň▒ÇÚâĘŃÇéňĆ»ŔŻŻŔŹ»ňż«šÉâšÜäŠáŞň┐âŠŐÇŠť»ňťĘń║Äň«×šÄ░ňłÜŠÇžňĺîň╝╣ŠÇžń╣őÚŚ┤šÜäň╣│Ŕíí´╝óÚťÇŔŽüŔóźňÄőš╝ꊥŹňůą´╝îňĆłňĆ»ń╗ąň┐źÚÇčňŤ×ň╝╣ňÉÄňŻ╝ŠşĄń╣őÚŚ┤š┤žň»ćš╗ôňÉłŃÇ銌ꊝčňĆ»ŔŻŻŔŹ»ňż«šÉâňĄÜŠś»ňîľšľŚŔŹ»šëęňĺîŔŻŻńŻôšÜäš«ÇňŹĽŠĚĚňÉł´╝îňťĘňůÂňÉÄš╗şňĆĹň▒ĽńŞş´╝îń║žňôüŠťŁŠáçňçćňîľš▓ĺňżäŃÇüÚóŚš▓ĺš╗äš╗çňłćňŞâŃÇüŔë»ňąŻšÜäšöčšëꚍŞň«╣ŠÇžšşëŠľ╣ňÉĹŔ┐şń╗ú´╝żšÄ░ňç║š▓żňçćŠ▓╗šľŚšÜäŠîüš╗şňĆĹň▒ĽŔÂőňŐ┐ŃÇé
ňĆ»ŔŻŻŔŹ»ňż«šÉâšÜäšÉćŠâ│ň║öšöĘňť║ŠÖ»ňîůŠőČ´╝Ü
ňĆ»ŔŻŻŔŹ»ňż«šÉâňťĘŠłĹňŤŻšÜäň║öšöĘňžőń║Ä2013-2014ň╣┤´╝îÚ║ŽšĹ×ÚÇÜňşÉňůČňĆŞBioSphereŠŚŚńŞőHepaSphereňĺîBTGňşÉňůČňĆŞBiocompatiblesŠŚŚńŞőšÜäDC/LC BeadsňůłňÉÄŔÄĚCFDAŠë╣ňçćńŞŐňŞé´╝îňłćňłźÚççšöĘń║ćŔüÜńŞÖšâ»ÚůŞÚů»´╝łń╣Öšâ»Úćç-ÚĺáńŞÖšâ»ÚůŞšŤÉ´╝ëňĺîŔüÜń╣Öšâ»Úćç´╝łPVA´╝ëšÜäŔ«żŔ«íš╗ôŠ×äŃÇéŔÇîňťĘňůĘšÉâŔîâňŤ┤ňćů´╝îŠ│░ň░öŔîéňťĘń╗úšÉćBTGňż«šÉâńŞÜňŐíňł░ŠťčňÉÄ´╝ŚńŞőÚççšöĘŔüÜń╣Öń║îÚćç´╝łPEG´╝ëLifePearlń║žňôüń║Ä2015ň╣┤ŔÄĚŠë╣CE´╝ŤňťĘŠ│óšžĹń╗ą42ń║┐šżÄňůâŠöÂŔ┤şBTGŔÄĚňżŚDC/LC Beadsń╣őňÉÄ´╝îň░ćňůÂňÄčTandem(OncoZene)šşëňż«šÉâń║žňôüńŞÜňŐíš║┐ń╗ą9,000ńŞçšżÄňůâňç║ňö«š╗Öń║ćšôŽÚçîň«ëňî╗šľŚŃÇ銳ĹňŤŻÚŽľńެňŤŻń║žňĆ»ŔŻŻŔŹ»ňż«šÉâCalliSpheresšö▒ŔőĆňĚ×Ŕ┐Žń┐Éšöčšöčšëę´╝ł2015ň╣┤ŔóźŠüĺšĹ×ňî╗ŔŹ»ŠöÂŔ┤ş´╝ëšáöňĆĹ´╝î2013ň╣┤ŔÄĚŠë╣CFDAŠ│ĘňćîŔ»üŃÇé2020ň╣┤ŠłĹňŤŻTACEŠëőŠť»ÚçĆŔ┐Ĺ70ńŞçńżő´╝îŠüĺšĹ׊Ľ┤ŠŁíňż«šÉâńŞÜňŐíń╣čň«×šÄ░Ŕ┐Ĺ10ń║┐ŔÉąŠöÂŃÇ隍«ň돴╝ĹňŤŻńŞ┤ň║Őšź»ŔŻŻŔŹ»ňż«šÉâň║öšöĘňŹáŠ»öňťĘ35%ňĚŽňĆ│´╝îÚóäŔ«í2025ň╣┤ňŹáŠ»öň░ćŠĆÉňŹçŔç│Ŕ┐Ĺ70%ŃÇé
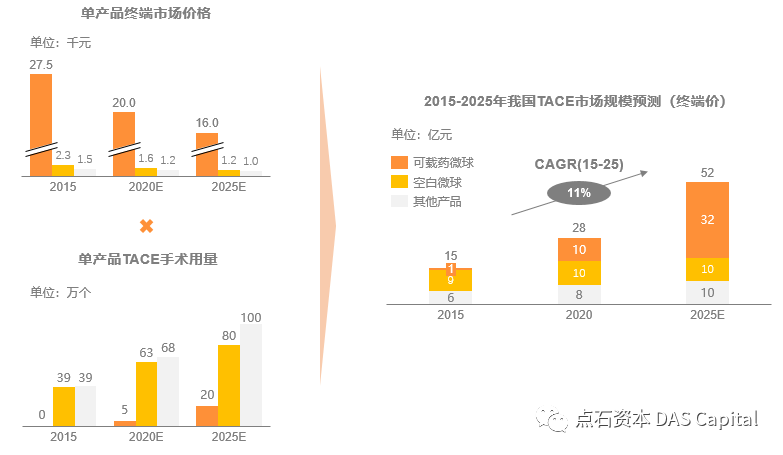
ňŤż2´╝ÜńŞşňŤŻTaceňŞéňť║ŔžäŠĘíńŞÄŠëőŠť»ÚçĆÚóäŠÁő
ń╗ÄŔŻŻŔŹ»ŠÇžŔâŻŔžĺň║Žšťő´╝îšÄ░ňťĘňŞéÚŁóńŞŐńŞ╗ŠÁüšÜäňż«šÉâń║žňôü´╝łDC Bead´╝îHepaSphere´╝îCalliSpheres´╝ëŔíĘÚŁóÚ⯊ś»Ŕ┤čšöÁŔŹĚ´╝îňŤáŠşĄŠÉşŔŻŻšÜäń╣čňč║ŠťČÚ⯊ś»Úś┐Úťëš┤áŃÇüŔíĘŠčöŠ»öŠśčŃÇüń╝ŐšźőŠŤ┐ň║ĚšşëŠşúšöÁŔŹĚŔŹ»šëę´╝îń╗ÄŔÇîň«×šÄ░ŔżâÚźśšÜäŔŻŻŔŹ»ňÉŞÚÖäšÄçŃÇ銺Ąš▒╗ŔŹ»šëęňĚ▓š╗ĆŔ┐çňůůňłćńŞ┤ň║ŐŔ»ĽÚ¬î´╝îÚĺłň»╣Ŕ飚ÖîŠ▓╗šľŚŠťëńŞÇň«ÜšÜ䊼łŠ×ť´╝îńŻćňťĘňůÂń╗ľšÖîšžŹŠ▓╗šľŚńŞşŔíĘšÄ░ń╗ŹńŞŹŠśÄŠťŚŃÇéňŤáŠşĄ´╝îň╝ÇňĆĹŠŤ┤ň╣┐Ŕ░▒šÜäŔŻŻŔŹ»ňż«šÉâń╗ąňĆŐšáöšęŠľ░ň×őšÜäŠÉşŔŻŻŔŹ»šëę´╝áŔ«║Šś»Úĺłň»╣ńŞşŠÖÜŠťčŔ飚ÖîňüÜŔ┐ŤńŞÇŠşąšľŚŠ│Ľń╝śňîľ´╝îŔ┐śŠś»ň░ćŔŻŻŔŹ»TACEŠ▓╗šľŚŠőôň▒ĽŔç│ňůÂń╗ľň«×ńŻôŠÇžŔäĆňÖĘšśĄŠłľÚŁ×Ŕé┐šśĄšÜäŔíÇš«íšľżšŚů´╝îÚ⯊äĆń╣ëÚçŹňĄžŃÇé
ŔÇîń╗Äňż«šÉ⊣ÉŔ┤Ęšťő´╝îŔüÜń╣Öšâ»ňč║ňÉíň廚âĚÚů«´╝łPVP´╝늳ľň░抳ÉńŞ║Šť¬ŠŁąšÜäńŞ╗ŠÁüňż«šÉ⊣ɊľÖŃÇéPVPŠś»ńŞÇšžŹšöčšÉćňşŽńŞŐš▒╗ń╝╝ń║║ńŻôŔíÇŠÁćŔŤőšÖŻšÜäÚźśňłćňşÉŔüÜňÉłšëę´╝»ÚŁ×šŽ╗ňşÉŔíĘÚŁóŠ┤╗ŠÇžňëéńŞşŠťÇňąŻšÜäńŞÇšžŹŃÇéň«âšÜäŠÇžŔ┤ĘšĘ│ň«Ü´╝îńŞ║ŠŚáŠ»ĺšëęŔ┤ĘŃÇüŠŚáŔçşŃÇüŠŚáňĹ│´╝îňůĚŠťëŠ×üňąŻšÜ䊳ÉŔćťŃÇüš▓śňÉłŃÇüŔžúŠ»ĺÚÖŹŠ»ĺňĺîš╝ôÚçŐšÜäňŐ芼łŃÇéPVPŔÁĚňłŁńŻťńŞ║ŔíÇŠÁćňó׊║ÂňëéńŻ┐šöĘ´╝îÚÜĆňÉÄšö▒ń║ÄňůÂń╝śŔ뻚ÜäšëęšÉćňîľňşŽŠÇžŔ⯴╝łňîůŠőČŠ×üŠśôŠ║Âń║ÄŠ░┤´╝îŔâŻńŞÄňĄÜšžŹÚźśňłćňşÉŃÇüńŻÄňłćňşÉšëęŔ┤Ęń║ĺŠ║ŠłľňĄŹňÉł´╝îšöčšëꚍŞň«╣ŠÇžňąŻšşë´╝ëŔÇîÚÇÉŠŞÉŠőôň▒ĽŔç│ŠŤ┤ňĄÜňť║ŠÖ»ŃÇ銺ĄňĄľ´╝îPVPňłćňşÉńŞşšÜäN-HŠłľO-HÚö«ŔâŻńŞÄšóśšÜäňłćňşÉš┤žň»ćš╗ťňÉł´╝îŔ┐ÖšžŹňłćňşÉÚŚ┤šÜäš╗ťňÉłŠťëŠĽłÚÖŹńŻÄń║ćšóśšÜäŔůÉŔÜÇŠÇžňĺîňł║Š┐ÇŠÇž´╝îńŻ┐ń║žňôüŠŤ┤ň«ëňůĘŃÇé
ňĆ»ŔŻŻŔŹ»ňż«šÉ⊝¬ŠŁąšÜäňŞéňť║Šâ│Ŕ▒íšę║ÚŚ┤ŔżâňĄž´╝«ňëŹňťĘŔâćš«íšÖľŔÇůš╗ôšŤ┤ŔéášÖîŔéŁŔŻČšž╗ÚóćňččňĚ▓ňłŁŠşąšž»š┤»ŔÁĚńŞÇń║ŤńŞ┤ň║Őšáöšę´╝îńŞ║ňÉÄš╗şňşŽŠť»šĽîšáöšęÂňąáň«Üń║抝ëňŐŤšÜ䊾╣ňÉĹ´╝ŤŠüĺšĹ×ń╣čňĚ▓š╗ĆňÉ»ňŐĘń║ćCalliSpheresŠ▓╗šľŚŔé║šÖîšÜäńŞ┤ň║ŐŔ»ĽÚ¬î´╝Şňů│Ŕ»ĽÚ¬îňĚ▓ňťĘńŞŐŠÁĚŃÇüň▒▒ńŞťŃÇüŠ▓│ňŹŚšşëňť░ň╝Çň▒ĽŃÇ銺ĄňĄľ´╝îÚÜĆšŁÇňłćňşÉÚŁÂňÉĹŔŹ»ňĺîňůŹšľźŠ▓╗šľŚÚóćňččšÜäńŞŹŠľşŠÄóš┤ó´╝îň»╣TACEŔüöšöĘňůÂń╗ľŠľ╣ň╝ĆšÜäšáöšęÂń╣čň░ćňĆ»ÚóäŔžüňť░ŠÄĘňŐĘŔíîńŞÜšÜäŠîüš╗şňĆĹň▒ĽŃÇé
ňŤż3´╝ÜńŞşňŤŻňî╗šżÄňŞéňť║ŔžäŠĘíńŞÄŠëőŠť»ÚçĆÚóäŠÁő
ń╝áš╗čňî╗šżÄŠ│Ęň░䊣ɊľÖňîůŠőČšÄ╗ň░┐ÚůŞŃÇüŔâÂňÄčŔŤőšÖŻšşë´╝îŔ┐Öš▒╗šëęšÉćňíźňůůňëéŔ┐ŤňůąšÜ«ŔéĄňÉÄ´╝îňíźňůůšëęňŹ│ňł╗ňĆŊö»ŠĺĹńŻťšöĘ´╝îňíźňůůšÜ«ŔéĄňç╣ÚÖĚ´╝îŔżżňł░šżÄň«╣ŠĽłŠ×ťŃÇéÚÜĆšŁÇňíźňůůšëęšÜäÚÖŹŔžúňĺîń╗úŔ░ó´╝îňÄ╗šÜ▒ŠĽłŠ×ťń╣čÚÇÉŠŞÉŠÂłňĄ▒´╝îšŐŠÇüš╗┤ŠîüŠŚÂÚŚ┤ŔżâščşŃÇéňĆŽňĄľ´╝îšö▒ń║ÄňĄęšäšÄ╗ň░┐ÚůŞš╗ôŠ×䊣żŠĽú´╝îŠ│Ęň░äšÄ╗ň░┐ÚůŞÚťÇŔŽüŠĚ╗ňŐáń║ĄŔüöňëé´╝îńŻ┐šÄ╗ň░┐ÚůŞŔâŻňĄčňŻóŠłÉšĘ│ň«ÜňŁÜňŤ║šÜ䚯ŚŐš╗ôŠ×äŃÇéń║ĄŔüöňëéńŞŹŠśôŔóźň«îňůĘÚÖŹŔžúňĺîňÉŞŠö´╝îŠ│Ęň░äňÉÄň«╣ŠśôňŻóŠłÉŠ«őšĽÖšëę´╝îÚÇኳÉÚĽ┐Šťčň«ëňůĘÚúÄÚÖęŃÇé
ÚÜĆšŁÇňî╗šżÄŠÂłŔ┤╣ňŹçš║ž´╝îŠÂłŔ┤╣ŔÇůŔŽüŠ▒銍┤ňąŻšÜäň«ëňůĘŠÇžňĺîŠ▓╗šľŚŠĽłŠ×ť´╝îň揚öčš▒╗Š│Ęň░䊣ɊľÖň║öŔ┐ÉŔÇîšöčŃÇéŔ┐Öš▒╗ń║žňôüńŞÄňŞŞŔžäšëęšÉćňíźňůůňëéńŞŹňÉî´╝îňůÂÚÇÜŔ┐çňł║Š┐ÇŔç¬Ŕ║źŔâÂňÄčŔŤőšÖŻň揚öč´╝îň«×šÄ░ŠŐŚŔí░ŔÇüšÜäňŐ芼łŃÇé
ńŞőňŤżń╗ąšźąÚóťÚĺłńŞ║ńżő´╝îň▒ĽšĄ║ń║ćň揚öčš▒╗ňî╗šżÄŠ│Ęň░äňëéń║žšöčńŻťšöĘšÜäŔ┐çšĘőŃÇéŠ│Ęň░äň돴╝îšÜ«Ŕ饚Ü▒š║╣ňĺîňç╣ÚÖĚŠâůňćÁŠśÄŠśżŃÇéŠ│Ęň░äňÉÄ´╝îňîůŔú╣šŁÇPLLA´╝łňĚŽŠŚőŔüÜń╣│ÚůŞ´╝ëňż«šÉâšÜäňíźňůůňëéŔ┐ŤňůąšÜ«Ŕ饴╝îŠö»ŠĺĹňëéšźőňł╗ňíźňůůňç╣ÚÖĚ´╝îŔÁĚňł░Šö»ŠĺĹńŻťšöĘ´╝îPLLAňłÖńŞŹŠľşňł║Š┐ÇŔç¬Ŕ║źš╗äš╗çń║žšöčŔâÂňÄčŔŤőšÖŻ´╝îŔ«ęšÜ«Ŕ饊üóňĄŹňł░Úą▒Š╗íšÜäšŐŠÇüŃÇéńŞ┤ň║ŐšáöšęÂŔíĘŠśÄ´╝îńŞÇšôÂSculptraňó×ňŐáŔâÂňÄčŔŤőšÖŻšÜäŠÇ╗ńŻôšž»š║Žšşëń║ÄńŞĄŠö»šÄ╗ň░┐ÚůŞšÜ䊼łŠ×ťŃÇéŠ│Ęň░äšöĘÚçĆńŞÄŠ▓╗šľŚŠÇ╗ÚŁóšž»šŤŞňů│´╝îšľŚšĘőŠČ튼░ńŞÄňç╣ÚÖĚšĘőň║ŽšŤŞňů│´╝îňĄÜŠĽ░Š▓╗šľŚŠĽłŠ×ťňĆ»ń┐ŁŠîüńŞĄň╣┤ŃÇé
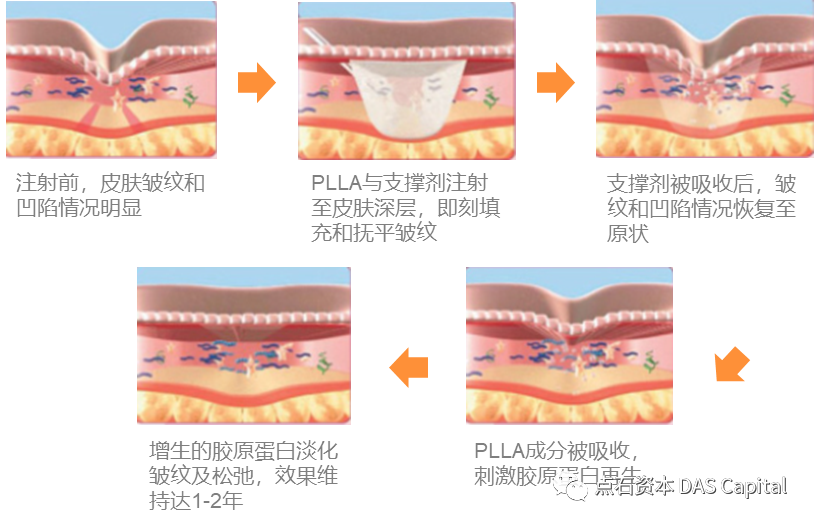
ňŤż4´╝ÜšźąÚóťÚĺłńŻťšöĘŔ┐çšĘő
šźąÚóťÚĺłšÜäŠáŞň┐⊳Éňłć´╝îPLLAŔüÜňĚŽŠŚőń╣│ÚůŞ´╝»ÚçŹŔŽüšÜäňî╗šöĘšöčšëęÚźśňłćňşÉŠŁÉŠľÖ´╝Üšö▒ňĆ»ň揚öčŔÁäŠ║ÉňŽéŔ░ĚšëꊳľŠĄŹšëęšžŞšžćšşëňĆĹÚůÁňżŚňł░ń╣│ÚůŞ´╝îÚÇÜŔ┐çš╝ęŔüÜŃÇüšâşŔžúŔüÜŃÇüň╝ǚĻŔüÜňÉłšşëńŞÇš│╗ňłŚňĆŹň║öňżŚňł░ňĆ»šöčšëęÚÖŹŔžúšÜäŔüÜňÉłšëęŃÇéPLLAňůĚŠťëŔë»ňąŻšÜäšöčšëꚍŞň«╣ŠÇžňĺîÚÖŹŔžúŠÇž´╝îňťĘń║║ńŻôňćůš╗ĆŠ░┤ŔžúŠłÉńŞ║ń╣│ÚůŞ´╝îÚÇÜŔ┐çńŞëšżžÚůŞňż¬šÄ»ń╗úŔ░óńŞ║ń║îŠ░žňîľšó│ňĺîŠ░┤´╝îň»╣ń║║ńŻôňŹüňłćň«ëňůĘŃÇé
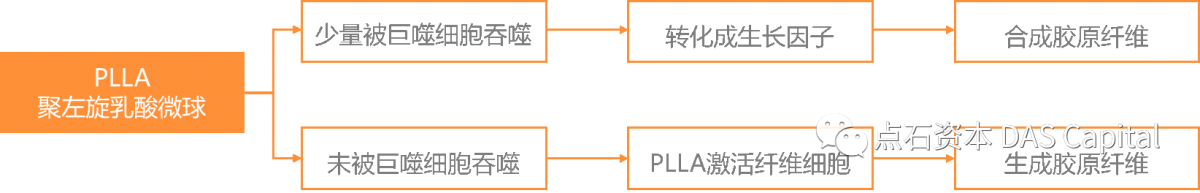
ňŤż5´╝ÜPLLAňż«šÉâńŻťšöĘňÄčšÉć
ňż«šÉâŠ│Ęň░äňÉÄ´╝îÚÇÜŔ┐çňł║Š┐ÇŔ║źńŻôšÜäňůŹšľźňĆŹň║ö´╝îňÉŞň╝ĽšÜ«ńŞőňĄžÚçĆšÜäňĚĘňÖČš╗ćŔâ×ňĺîňůÂń╗ľňůŹšľźš╗ćŔâ×´╝îŔ┐Öń║Ťš╗ćŔâ×ń║žšöčŔÂőňîľňŤáňşÉňĺîš╗ćŔâ×ňŤáňşÉ´╝îŠ┐ÇŠ┤╗š║Ąš╗┤š╗ćŔâךÜäňó׊«ľňĆŐŔéɚ║Ąš╗┤š╗ćŔâךÜäňłćňîľ´╝îňÉłŠłÉňĄžÚçĆŔâÂňÄčŔŤőšÖŻ´╝îŠüóňĄŹšÜ«ńŞőň«╣ÚçĆ´╝îň╝ąŔíąŔâÂňÄčŠÁüňĄ▒´╝îŠüóňĄŹÚą▒Š╗íšÜ«ŔéĄŃÇéŔŽüŔżżňł░šÉćŠâ│ŠĽłŠ×ť´╝îň»╣PLLAňż«šÉâšÜäšëęšÉćňĺîňîľňşŽšë╣ŠÇžŠťëšŁÇńŞąŠá╝šÜäŔŽüŠ▒é´╝Ü
ÚÖĄšźąÚóťÚĺłňĄľ´╝îň░Ĺňą│Úĺłń║ŽŠś»ňŞéÚŁóńŞŐńŻ┐šöĘň╣┐Š│ŤšÜäň揚öčš▒╗Š│Ęň░äń║žňôü´╝îňůÂńŻťšöĘňÄčšÉćńŞÄšźąÚóťÚĺłňŁçńŞ║ňł║Š┐ÇŔç¬Ŕ║źŔâÂňÄčŔŤőšÖŻň揚öčŃÇéň░Ĺňą│ÚĺłšÜäńŞ╗ŔŽüŠłÉňłćŠś»30%ŔüÜňĚ▒ňćůÚů»´╝łPCL´╝ëňż«šÉâ+70%šżžšö▓ňč║š║Ąš╗┤š┤áÚĺá´╝łCMC´╝ëňçŁŔâÂŔŻŻńŻô´╝«ňëŹňŞéÚŁóńŞŐńŞ╗ŠÁüń║žňôüňƬŠťëňŹÄńŞťňî╗ŔŹ»ŠŚŚńŞőšÜäEllanse-SŃÇéńŞĄŔÇůšŤŞŔżâ´╝îšźąÚóťÚĺłń╝śňŐ┐ŠŤ┤ńŞ║ŠśÄŠśż´╝¬ŠŁąňŞéňť║šę║ÚŚ┤ŠŤ┤ňĄžŃÇé

ňŤż6´╝ÜšźąÚóťÚĺłň»╣Š»öň░Ĺňą│Úĺł
ňůĘšÉâňî╗šżÄňŞéňť║ńŞŐ´╝îÚźśňżĚšżÄšÜäSculptraŃÇüšżÄňŤŻDerma VeilňĺîÚčęňŤŻReganšÜäAesthFillňçáŠČżšźąÚóťÚĺłńŞ║ńŞ╗ŠÁüń║žňôüŃÇé2021ň╣┤ń╣őň돴╝ĹňŤŻňÉłŔžäň揚öčš▒╗ňî╗šżÄňŞéňť║ňĄäń║Äšę║šÖŻŃÇéÚÜĆšŁÇń╗Őň╣┤ÚĽ┐ŠśąňťúňŹÜšÄŤŃÇüšł▒šżÄň«óńŞĄŠČżIIIš▒╗Šó░šźąÚóťÚĺłŔÄĚŠë╣ńŞŐňŞé´╝îňÉłŔžäń║žňôüň░ćň»╣Š░┤Ŕ┤žń║žšö芍┐ń╗úŃÇéAestheFill 6ŠťłňÉ»ňŐĘń║ćšöĘń║ÄŠö╣ňľäÚ╝╗ňöçŠ▓čšÜ▒š║╣šÜäNMPAŠ│Ęň░äńŞ┤ň║Őšáöšę´╝îSculptraňĄäń║ÄNMPAšö│ŠŐąÚśÂŠ«ÁŃÇéŔÇîňťĘňëéň×őŠľ╣ÚŁó´╝îňĄžÚâĘňłćšźąÚóťÚĺłňŁçńŞ║š▓ëňëéňîůŔúů´╝îšöčń║žŠŚÂňĆ»ń╗ąÚççšöĘš╗łšź»šüşŔĆîňĚąŔë║´╝ɊťČńŻÄ´╝îŔ┤žŠ×Âň»┐ňĹŻÚĽ┐´╝îńŻ┐šöĘŠŚÂÚťÇŔŽüńŞ┤ň║Őňî╗šöčŠĚ╗ňŐášöčšÉ暍Ɋ░┤ŃÇéšł▒šżÄň«óšźąÚóťÚĺłňłÖŠś»ÚóäšüîŠ│ĘšÜäÚĺłňëé´╝îňÉźŠťëšöčšÉ暍Ɋ░┤ňĺîňłęňĄÜňŹíňŤáŃÇé

ňŤż7´╝ÜšźąÚóťÚĺłńŞ╗ŔŽüń║žňôüŠó│šÉć
ŠłĹń╗ČŔ«ĄńŞ║´╝îšëîšůžńŞ║šÄ░ڜŠ«ÁšźąÚóťÚĺłšź×ń║ëšÜäŠáŞň┐â´╝îÚĽ┐Šťčšź×ń║ëňłÖŔŽüńżŁÚŁáń║žňôüňĚąŔë║ňĺáÚüôń╝śňŐ┐ŃÇéŠÄîŠĆíń║ćňż«šÉâŠáŞň┐âŠŐÇŠť»šÜäňÄéň«Â´╝ëŔâŻňŐŤšöčń║žňç║Ŕ┤Ęňť░ňŁçňîÇŃÇüňŻóŠÇüŔžäňłÖŃÇüňĆ»Šîüš╗şňł║Š┐ÇŔâÂňÄčň揚öčšÜäňŤŻń║žšźąÚóťÚĺłń║žňôü´╝늝ŤňťĘšź×ń║ëńŞşŔä▒ÚóľŔÇîňç║ŃÇé
Šáôňí×ňż«šÉâňĺîňî╗šżÄňż«šÉâÚóćňčč´╝îňĚ▓ŠťëŠäłŠŁąŠäłňĄÜšÜäňŤŻń║žń╝üńŞÜň╝ÇňžőňŞâň▒ÇŠÄóš┤ó´╝îńŞ╗ŔŽüňÄéň«ÂňîůŠőČ´╝Ü
´╝ł1´╝ë┬á┬á┬á┬áŠüĺšĹ×ňî╗ŔŹ»
2015ň╣┤´╝îŠüĺšĹ×ňî╗ŔŹ»ŠöÂŔ┤şŔőĆňĚ×Ŕ┐Žń┐Éšöčšöčšëę´╝îŔÄĚňżŚŠŚŚńŞőCalliSpheresňĆ»ŔŻŻŔŹ»Šáôňí×ňż«šÉâń║žňôü´╝úň╝ĆŔ┐Ťňůąňî╗šľŚňÖĘŠó░ÚóćňččŃÇéŔ»ąń║žňôü2013ň╣┤ŔÄĚŠë╣CFDAŠ│ĘňćîŔ»ü´╝îńŞ║ňŤŻňćůÚŽľńެŔÄĚŠë╣šÜ䚍Şňů│ń║žňôü´╝îŠőąŠťëšőČšźőščąŔ»ćń║žŠŁâŃÇ銝ëňů│CalliSpheresšÜäňĄÜńެńŞ┤ň║ŐŠĽ░ŠŹ«ňůłňÉÄňĆĹŔíĘń║ÄDrug DeliveryŃÇüJ Cancer Res Clin OncolŃÇüMedicinešşëSCIŠŁéň┐Ś´╝îšáöšęŠłÉŠ×ťń╣čňůłňÉÄňťĘňĄÜńެňŤŻÚÖůňĄžń╝ÜŔ┐ŤŔíîňĆúňĄ┤Š▒çŠŐąň▒ĽšĄ║ŃÇé
´╝ł2´╝ë┬á┬á┬á┬᚞ŚŁ┐Úę░ňî╗šľŚ
šžĹšŁ┐Úę░ňî╗šľŚŠłÉšźőń║Ä2015ň╣┤´╝îŠÇ╗ÚâĘńŻŹń║ÄŠĚ▒ňť│´╝îńŞôŠ│Ęń║ÄŔé┐šśĄń╗őňůąňĺîň┐âŔäĹŔíÇš«íń╗őňůąń║žňôüšÜäšáöňĆĹŃÇéňůČňĆŞňťĘňż«šÉâÚóćňččňĚ▓ňŞâň▒ÇňĄľňĹĘŠáôňí×ňż«šÉâŃÇüňż«ň»╝š«íšşëňĄÜńެń║žňôü´╝îŠáŞň┐âňĆ»ŔŻŻŔŹ»ňż«šÉâň»╣ŠáçŠüĺšĹ×CalliSpheresń║žňôü´╝«ňëŹń║žňôüŠşúňťĘńŞ┤ň║ŐŔ»ĽÚ¬îńŞş´╝îÚóäŔ«íň░ćń║Ä2021-2022ň╣┤Šő┐Ŕ»üŃÇé
´╝ł3´╝ë┬á┬á┬á┬ášł▒šżÄň«ó
ňî╗šżÄňĚĘňĄ┤ŃÇüÔÇťňą│ń║║šÜäŔîůňĆ░ÔÇŁÔÇöÔÇöšł▒šżÄň«óŠÇ╗ÚâĘńŻŹń║ÄňîŚń║Č´╝»ňŤŻňćůÚóćňůłšÜäňî╗šżÄŔŻ»š╗äš╗çń┐«ňĄŹŠŁÉŠľÖńżŤň║öňĽć´╝îňůČňĆŞŠś»ňĄÜÚí╣ňż«ňłŤŠ│Ęň░äIIIš▒╗ňî╗šľŚňÖĘŠó░ÚóćňččšÜäÚŽľň«ÂNMPAŠ│ĘňćîŔ»üń╣ŽňĆľňżŚŔÇů´╝»šŤ«ňëŹňŤŻń║žŠÇ╗ňç║Ŕ┤žÚóŁŠťÇÚźśšÜäšÄ╗ň░┐ÚůŞš▒╗Š│Ęň░äňíźňůůŠŁÉŠľÖńżŤň║öňĽćŃÇ隍«ňëŹňůČňĆŞŠŚŚńŞőšźąÚóťÚĺłń║žňôüÔÇöÔÇöPLLA´╝łňĚŽŠŚőŔüÜń╣│ÚůŞ´╝ëń║žňôüňĚ▓ń║Ä2021ň╣┤6ŠťłŔÄĚNMPAŠë╣ňçćńŞŐňŞéŃÇé
´╝ł4´╝ë┬á┬á┬á┬áÚĽ┐ŠśąňťúňŹÜšÄŤ
ÚĽ┐ŠśąňťúňŹÜšÄŤšöčšëꊣɊľÖŠťëÚÖÉňůČňĆŞŠłÉšźőń║Ä2007ň╣┤´╝îňůČňĆŞń╗ąňĆ»ŠÄžÚźśňłćňşÉŔüÜňÉłŠŐÇŠť»ňĺîňĄÜňŤáňşÉÚźśňłćňşÉšëęšÉćŠö╣ŠÇžŠŐÇŠť»ńŞ║ŠáŞň┐âŔâŻňŐŤ´╝îŔžäŠĘíňîľňłÂňĄçňî╗šöĘŔÂůÚźśŠÇžŔ⯚öčšëęŠ┤╗ŠÇžŔüÜń╣│ÚůŞŃÇéňůČňĆŞŠŚŚńŞőšźąÚóťÚĺłń║žňôüÔÇöÔÇöPLAňż«šÉâš▓ëňëéňĚ▓ń║Ä2021ň╣┤4ŠťłŔÄĚNMPAŠë╣ňçćńŞŐňŞéŃÇéŔ»ąń║žňôüńŞ║š║»PLAňż«š▓ĺ´╝îšöĘšöśÚť▓Úćçňĺîšżžšö▓ňč║š║Ąš╗┤š┤áÚĺáńŻťńŞ║ňż«š▓ĺšÜäňłćŠĽúňëé´╝îŠ▓튝ëšÄ╗ň░┐ÚůŞšÜäňíźňůůńŻťšöĘńŞÄÚÜöšŽ╗ňłćŠĽúńŻťšöĘ´╝늯ťňťĘšÜäŔ»▒ňĆĹň▒ÇÚâĘš╗ôŔŐéšÜäÚúÄÚÖęŃÇé
´╝ł5´╝ë┬á┬á┬á┬ášÄ«Š▓Éňî╗šľŚ
šÄ«Š▓Éňî╗šľŚŠłÉšźőń║Ä2020ň╣┤´╝îŠÇ╗ÚâĘńŻŹń║ÄńŞŐŠÁĚ´╝îňŞîŠťŤŠ×äň╗║ňč║ń║Äš╗äš╗çŔâŠŐÇŠť»ňĺîňż«šĆáŠŐÇŠť»šÜäňłŤŠľ░ň×őšöčšëęňî╗ňşŽŠŁÉŠľÖň╣│ňĆ░ŃÇ隍«ňëŹňůČňĆŞ2ŠČżŠáŞň┐âń║žňôü´╝îňĆ»ŔŻŻŔŹ»Šáôňí×ňż«šÉâňĺîšÄ╗ň░┐ÚůŞňż«šÉâňŹ│ň░ćŔ┐ŤňůąńŞ┤ň║ŐŔ»ĽÚ¬îŃÇé
ňůŹŔ┤úňú░ŠśÄ
šŤŞňů│ňćůň«╣ňč║ń║ÄňĚ▓ňůČň╝ÇšÜäŔÁ䊾֊łľń┐íŠü»Šĺ░ňćÖ´╝îńŻćŠťČňůČňĆŞńŞŹń┐ŁŔ»üŔ»ąšşëń┐íŠü»ňĆŐŔÁ䊾֚Üäň«îŠĽ┤ŠÇžŃÇüňçćší«ŠÇž´╝îŠëÇňÉźń┐íŠü»ňĆŐŔÁ䊾Öń┐ŁŠîüňťĘŠťÇŠľ░šŐŠÇüŃÇéňÉ´╝ČňůČňĆŞŠťëŠŁâň»╣ŠťČŠŐąňĹŐŠëÇňÉźń┐íŠü»ňťĘńŞŹňĆĹňç║ÚÇÜščąšÜäŠâůňŻóńŞőňüÜňç║ń┐«Šö╣´╝îÚśůŔ»╗ŔÇůň║öňŻôŔç¬Ŕíîňů│Š│ĘšŤŞň║öšÜ䊍┤Šľ░Šłľń┐«Šö╣ŃÇé
ňťĘń╗╗ńŻĽŠâůňćÁńŞő´╝Ț»çŠľçšźáńŞşšÜäń┐íŠü»ŠłľŠëÇŔíĘŔ┐░šÜäŠäĆŔžüňŁçńŞŹŠ×䊳Éň»╣ń╗╗ńŻĽń║║šÜäŠŐĽŔÁäň╗║Ŕ««´╝áŔ«║Šś»ňÉŽňĚ▓š╗ĆŠśÄšĄ║ŠłľŠÜŚšĄ║´╝ȊչňĹŐńŞŹŔâŻńŻťńŞ║Úüôń╣ëšÜäŃÇüŔ┤úń╗╗šÜäňĺîŠ│ĽňżőšÜäńżŁŠŹ«ŠłľŔÇůňçşŔ»üŃÇéňťĘń╗╗ńŻĽŠâůňćÁńŞő´╝ČňůČňĆŞń║ŽńŞŹň»╣ń╗╗ńŻĽń║║ňŤáńŻ┐šöĘŠťČŠľçšźáńŞşšÜäń╗╗ńŻĽňćůň«╣ŠëÇň╝ĽŔç┤šÜäń╗╗ńŻĽŠŹčňĄ▒Ŕ┤čń╗╗ńŻĽŔ┤úń╗╗ŃÇ銝Ȋľçšźáń╗ůńŞ║ŠťČňůČňĆŞŠëÇŠťë´╝¬š╗Ćń║őňůłń╣ŽÚŁóŔ«ŞňĆ»´╝îń╗╗ńŻĽŠť║Š×äňĺîńެń║║ńŞŹňżŚń╗ąń╗╗ńŻĽňŻóň╝Ćš┐╗šëłŃÇüňĄŹňłÂŃÇüňĆĹŔíĘŃÇüŔŻČňĆĹŠłľň╝ĽšöĘŠťČŠŐąňĹŐšÜäń╗╗ńŻĽÚâĘňłćŃÇé