ŠŹ«š╗čŔ«í´╝îń║║š▒╗ŔŤőšÖŻńŞşŠťëŠÄąŔ┐Ĺ80%ŔŤőšÖŻŠŚáŠśżŔĹŚŠ┤╗ŠÇžńŻŹšé╣´╝îń╝áš╗čńŞŐŔóźŔ«ĄńŞ║Šś»ńŞŹňĆ»ŠłÉŔŹ»ÚŁÂšé╣ŃÇéń╝áš╗čšÜäڣŠáçňĄžÚâĘňłćŠś»ňůĚŠťëŠśÄší«Š┤╗ŠÇžńŻŹšé╣šÜäŔŤőšÖŻ´╝îńŞöÚÇéňÉłš╗ôňÉłň░ĆňłćňşÉ´╝îň╣ÂńŞ╗ŔŽüÚÇÜŔ┐çňŹáŠŹ«Š┤╗ŠÇžńŻŹšé╣šÜäŔŹ»šÉćňşŽńŻťšöĘŠĘíň╝Ć (MOA) ŠŁąŠÄžňłÂŔŤőšÖŻňŐčŔâŻŃÇéŔ┐ÖšžŹŠľ╣Š│ĽŔÖŻšäš«ÇňŹĽ´╝îńŻćŠś»ň╣ÂńŞŹŔâŻň║öšöĘń║ÄŠëÇŠťëšöčšëęڣŠáç´╝îňîůŠőČÚéúń║Ťš╝║ń╣ĆÚůŠ┤╗ŃÇüŠŤżŔóźŔ«ĄńŞ║Šś»ŃÇîńŞŹňĆ»ŠłÉŔŹ»ŃÇŹšÜäڣŠáç´╝îń╗ąňĆŐÚÇÜŔ┐皬üňĆśňĆŹňĄŹŔÇÉŔŹ»ŃÇüšÄ░ڜŠ«ÁŠŚáŔŹ»ňĆ»Š▓╗šÜäڣŠáçŃÇéňŤáŠşĄÚĽ┐Šťčń╗ąŠŁą´╝îÚŁÂňÉĹŔŤőšÖŻšÜäŔŹ»šëęšáöňĆĹňĆŚÚÖÉń║ÄŠťëÚÖÉšÜäŔŤőšÖŻšžŹš▒╗´╝îŠ×üňĄžňť░ÚÖÉňłÂń║ćŔŹ»šëęňĆĹň▒ĽŃÇé
Ŕç¬ŔÇÂÚ▓üňĄžňşŽšÜäCraig CrewsŠĽÖŠÄłňŤóÚśčÚŽľŠČíŠŐąÚüôń║ćň░ĆňłćňşÉPROTACňÉÄšÜäňŹüň╣┤ÚŚ┤´╝îPROTACÚóćňččÚú×ÚÇčňĆĹň▒ĽŃÇéŔŹ»šëęڣŠáçšÜäŠá╝ň▒Çń╣čňŤáŠşĄňĆĹšöčń║ćÚçŹňĄžňĆśňîľ´╝îń╗Äń╝áš╗čŔŹ»šëęڣŠáçŔŻČňÉĹŠŤ┤ňůĚŠîĹŠłśŠÇžšÜäڣŠáçŃÇé
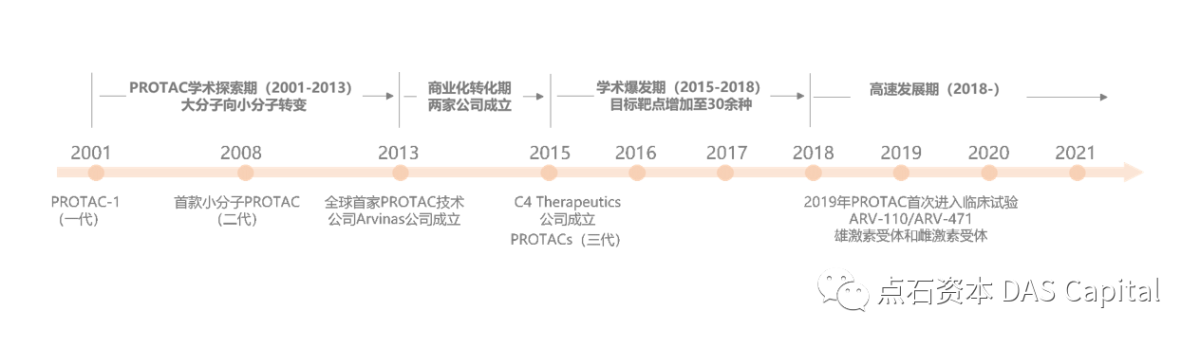
š║ÁŔžéPROTACŠŐÇŠť»ňĆĹň▒ĽňÄćňĆ▓´╝î2001ň╣┤ÚŽľńެPROTACňłćňşÉPROTAC-1Ŕ»×šöč´╝»šö▒PROTACŠŐÇŠť»ňůłÚę▒CrewsňĆŐňůÂňÉîń║őŠŐąÚüô´╝Ť2008ň╣┤´╝îšČČńŞÇńެň░ĆňłćňşÉPROTACŔ»×šöč´╝îňÉîŠáĚšö▒CrewsŔ»żÚóśš╗äŔ«żŔ«íňÉłŠłÉ´╝»šö▒ÚŁÂňÉĹMDM2 E3Š│Ťš┤áŔ┐׊ĹÚůšÜäň░ĆňłćňşÉŠŐĹňłÂňëénutlinňĺîARň░ĆňłćňşÉÚůŹńŻôń╗ąňĆŐńŞşÚŚ┤šÜäPEG LinkerŠ×䊳ɴ╝Ťń╣őňÉÄ´╝îšáöšęÂŔÇůň╝ÇňĆĹňç║ń╗ąCRL4CRBNŃÇüCRL2VHLŃÇücIAPE3Š│Ťš┤áŔ┐׊ĹÚůÂÚůŹńŻôšÜäňÉäšžŹň░ĆňłćňşÉPROTACs´╝ŤňćŹń╣őňÉÄ´╝îArvinasňůČňĆŞšáöňĆĹšÜäARV-110ňĺîARV-471ńŞĄńެPROTACňłćňşÉŔ┐ŤňůąńŞ┤ň║Őň«×Ú¬î´╝îňłćňłźšöĘń║ÄŠ▓╗šľŚňëŹňłŚŔů║šÖîňĺîń╣│Ŕů║šÖîŃÇé
ňŤż´╝ÜPROTACÚçîšĘőšóĹŠŚÂÚŚ┤šé╣
PROTAC ŠŐÇŠť»šÜäňç║šÄ░´╝îń╗ąňůÂÚóáŔŽćŠÇžšÜäŔ«żŔ«íŃÇüÚóáŔŽćŠÇžšÜäńŻťšöĘŠť║ňłÂŠîĹŠłśń║ćŃÇîńŞŹňĆ»ŠłÉŔŹ»ŃǏڣšé╣´╝îńŻ┐ŔÇÉŔŹ»ŠéúŔÇůŔÄĚňżŚŠľ░ńŞÇń╗úŠ▓╗šľŚŔŹ»šëęŃÇéŔ┐ĹńŞĄň╣┤ŠŁą´╝îPROTAC ŠŐÇŠť»Ŕ┐ŤňůąÚźśÚÇčňĆĹň▒ĽÚśÂŠ«Á´╝îńŞ║šöčšëęňî╗ŔŹ»šáöňĆĹň╝ÇŠőôń║ćńŞÇšë犾░šÜäÚóćňččŃÇé
ńŞÇŃÇüŠŐÇŠť»ňÄčšÉćÔÇöÔÇöŠ│Ťš┤áń╗őň»╝šÜäŔŤőšÖŻÚÖŹŔžúš│╗š╗č
ŔŤőšÖŻŔ┤ĘŠś»š╗ćŔâ×ňćůÚçŹŔŽüšÜäšöčšëęňĄžňłćňşÉ´╝îňĆéńŞÄňĄÜšžŹšöčňĹŻŠ┤╗ňŐĘ´╝îňîůŠőČÚůÂňĺîŠ┐Çš┤ášÜäňŐčŔâŻŃÇüŔ┐ÉňŐĘŃÇüŔ┐ÉŔżôŃÇüňůŹšľźňĆŹň║öšşëŃÇéń╗ąňżÇ´╝îń║║ń╗ČÚŁ×ňŞŞňů│Š│ĘŔŤőšÖŻŔ┤ĘňťĘš╗ćŔâ×ňćůŠś»ňŽéńŻĽňÉłŠłÉšÜä´╝îńŻćň»╣ń║ÄŔŤőšÖŻŔ┤ĘňťĘš╗ćŔâ×ňćůŠś»ňŽéńŻĽÚÖŹŔžúšÜäňŹ┤ň░ĹŠťëń║║ňů│Š│ĘŃÇéń╗ąŔë▓ňłŚšžĹňşŽň«ÂAaron CiechanoverŃÇüAvram HershkoňĺîšżÄňŤŻšžĹňşŽň«ÂIrwin RoseňĆĹšÄ░ń║ćŠ│Ťš┤áń╗őň»╝šÜäŔŤőšÖŻŔ┤ĘÚÖŹŔžúŠť║ňłÂ´╝îňů▒ňÉîŔÄĚňżŚń║ć2004ň╣┤Ŕ»║Ŕ┤Łň░öňîľňşŽňąľŃÇé
Š│Ťš┤ኝČŔ║źń╣芜»ńŞÇšžŹňĄÜŔ鯴╝îšö▒76ńެŠ░Ęňč║ÚůŞŠ«őňč║š╗䊳ɴ╝îň║ĆňłŚÚźśň║Žń┐Łň«ł´╝îńŞöňťĘňĄÜšžŹšťčŠáŞšöčšëęńŞşŠÖ«ÚüŹňşśňťĘŃÇéŠ│Ťš┤ášÜäńŞ╗ŔŽüňŐčŔ⯊ś»ŠáçŔ«░ÚťÇŔŽüňłćŔžúšÜäŔŤőšÖŻŔ┤Ę´╝îňŻôŠ│Ťš┤áŔ┐׊Ĺňł░ŔŤőšÖŻńŞŐňÉÄ´╝îń╝Üň»╝Ŕç┤Ŕ┐Öń║ŤŔŤőšÖŻŔóźŔ┐ÉÚÇüňł░ŔŤőšÖŻÚůÂńŻôńŞşŔ┐ŤŔíîÚÖŹŔžú´╝îň«×šÄ░š╗ćŔâ×ňćůŔŤőšÖŻšÜäň╣│ŔííŃÇéŠÇ╗šÜ䊣ąŔ»┤´╝îŠ│Ťš┤áňĆéńŞÄń║ćš╗ćŔâ×ňĹĘŠťčŃÇüňó׊«ľŃÇüňçőń║íŃÇüňłćňîľŃÇüŔŻČšž╗ŃÇüňč║ňŤáŔíĘŔżżŃÇüŔŻČňŻĽŔ░âŔŐéŃÇüń┐íňĆĚń╝áÚÇĺŃÇüŠŹčń╝Ąń┐«ňĄŹŃÇüšéÄšŚçňůŹšľźšşëňçáń╣ÄńŞÇňłçšöčňĹŻŠ┤╗ňŐĘšÜäŔ░âŠÄžŃÇé
Š│Ťš┤áňîľ´╝îńŞ╗ŔŽüšö▒3šžŹÚůÂňéČňîľ´╝îňŹ│E1Š│Ťš┤áŠ┤╗ňîľÚůÂŃÇüE2Š│Ťš┤áš╗ôňÉłÚůÂŃÇüE3Ŕ┐׊ĹÚůÂŃÇéňťĘATPšÜäńŻťšöĘńŞő´╝îŠ│Ťš┤áń╝ÜŔóźŠ┐ÇŠ┤╗´╝îňůłňŻóŠłÉŠ│Ťš┤á-Ŕů║ŔőĚÚůŞňĄŹňÉłšëę´╝îňćŹŔóźŔŻČšž╗ňł░Š│Ťš┤áŠ┤╗ňîľÚůÂE1ńŞŐ´╝ŤÚÜĆňÉÄ´╝îE1ň░ćŠ┤╗ňîľšÜäŠ│Ťš┤áŔŻČšž╗ňł░Š│Ťš┤áš╗ôňÉłÚůÂE2ńŞŐ´╝ŤŠťÇš╗ł´╝îŠ│Ťš┤áŔ┐׊ĹÚůÂE3ň░ćŠ│Ťš┤áŔŻČšž╗ňł░šŤ«ŠáçŔŤőšÖŻńŞŐ´╝îň░▒ňâĆŠś»ŠëôńŞŐÔÇťŠŞůÚÖĄÔÇŁšÜäŠáçšşżŃÇéŔ┐Öń║ŤŔóźŠëôńŞŐŠáçšşżšÜ䚍«ŠáçŔŤőšÖŻ´╝îń╣čń╝ÜŔóźÚÇüňł░ŔŤőšÖŻÚůÂńŻôňĄŹňÉłńŻôňĄäŔ┐ŤŔíîÚÖŹŔžúŃÇé
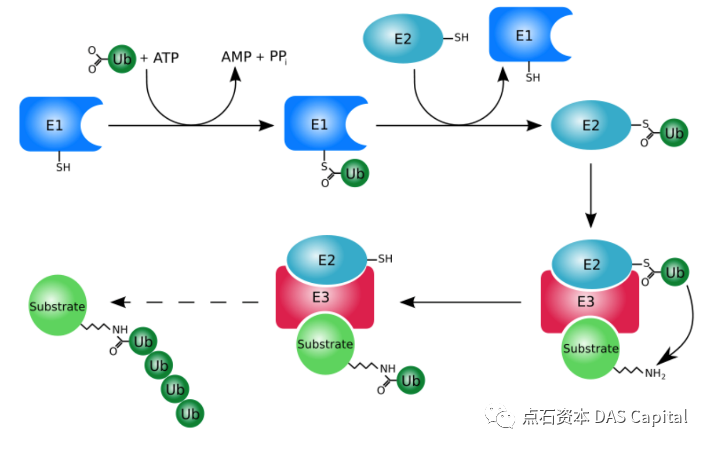
ňŤż´╝ÜŠ│Ťš┤áňîľšĄ║ŠäĆňŤż
PROTAC´╝łPROteolysis TArgeting Chimeras´╝îŔŤőšÖŻÚÖŹŔžúÚŁÂňÉĹňÁîňÉłńŻô´╝ëšö▒ńŞëšžŹňůâš┤áš╗䊳ɴ╝ÜE3Š│Ťš┤áŔ┐׊ĹÚůÂÚůŹńŻôŃÇüÚŁÂŔŤőšÖŻÚůŹńŻôňĺîLinkerŃÇéE3Š│Ťš┤áŔ┐׊ĹÚůÂÚůŹńŻôŔ┤čŔ┤úšë╣ň╝éŠÇžŠőŤňőčE3Š│Ťš┤áŔ┐׊ĹÚů´╝ŤÚŁÂŔŤőšÖŻÚůŹńŻôšöĘń║ÄÚŁÂňÉĹňĺĽŔÄĚšŤ«ŠáçŔŤőšÖŻ´╝ŤLinkeršöĘń║Äš╗ôňÉłŔ┐ÖńŞĄńެÚůŹńŻô´╝îňŻóŠłÉšĘ│ň«ÜšÜäńŞëňůâňĄŹňÉłšëęŃÇé
PROTACňłćňşÉŔâŻňĄčň░ćE3Š│Ťš┤áŔ┐׊ĹÚůÂňőčÚŤćňł░ڣšé╣ŔŤőšÖŻÚÖäŔ┐Ĺ´╝îńŞ║ڣšé╣ŔŤőšÖŻŠëôńŞŐŠ│Ťš┤áÔÇťŠáçšşżÔÇŁŃÇéňťĘš╗ćŔâ×ńŞş´╝îŠëôńŞŐŠ│Ťš┤áÔÇťŠáçšşżÔÇŁšÜäŔŤőšÖŻň░ćŔóźÚÇüňůąŔŤőšÖŻÚůÂńŻôŔ┐ŤŔíîÚÖŹŔžúŃÇéÚŁÂŔŤőšÖŻÚÖŹŔžúňÉÄ´╝îPROTACňłćňşÉňĆłňĆ»ń╗ąŔóźÚçŐŠöżňç║ŠŁąňĆéńŞÄňł░ńŞőńŞÇńެŔŤőšÖŻšÜäÚÖŹŔžúŔ┐çšĘő´╝îňŤáŠşĄŔ┐ÖšžŹÚÖŹŔžúńŻťšöĘňůĚŠťëňéČňĽłŠ×ť´╝îŔżâň░ĹšÜäŔŹ»šëęňëéÚçĆň░▒ňĆ»ń╗ąň«×šÄ░ÚźśŠĽłšÜäÚÖŹŔžúŃÇé
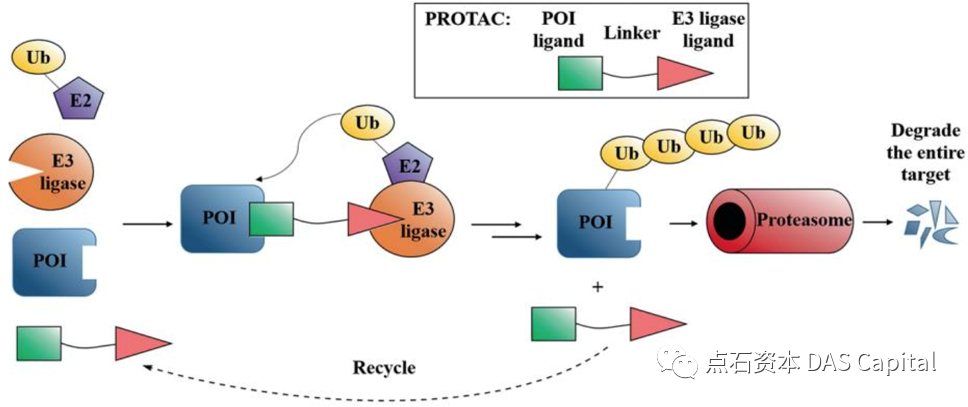
ňŤż´╝ÜPROTACÚÇÜŔ┐çŠ│Ťš┤áŔ░âŔŐéšÜäŔŤőšÖŻÚÖŹŔžúňĆĹŠîąŔŹ»ŠĽł
šŤ«ň돴╝îš╗ćŔâ×ňćůÚŁÂŔŤőšÖŻŔíĘŔżżŠ░┤ň╣│šÜäŔ░âŠÄžńŞ╗ŔŽüňĆ»ń╗ąń╗ÄńŞëńެň▒éÚŁóŔ┐ŤŔíîň╣▓Úóä:´╝ł1´╝ëňťĘňč║ňŤáň▒éÚŁóŔ┐ŤŔíîÚŁÂŔŤőšÖŻšÜäŔ░âŠÄžŠŐÇŠť»´╝îńżőňŽéŔ┐Ĺň╣┤ňů┤ŔÁĚšÜäňč║ňŤáš╝ľŔżĹŠŐÇŠť»(CRISPR-Cas9)´╝îń╝śšé╣´╝Üš▓żší«ň║ŽÚźśńŞöÚÇÜšöĘŠÇžň╝║šşë´╝îš╝║šé╣´╝ÜńŞŹŔâŻň»╣ÚŁÂŔŤőšÖŻŔ┐ŤŔíîňŐĘŠÇüŔ░âŠÄž´╝îň╣ÂňůĚŠťëńŞŹňĆ»ÚÇćŠÇžń╗ąňĆŐňşśňťĘŠŻťňťĘšÜäÚüŚń╝áŔíąňü┐ŠĽłň║ö;´╝ł2´╝ëňťĘŔŻČňŻĽň▒éÚŁóÚÇÜŔ┐çRNAň╣▓Šë░ŠŐÇŠť»ÚŁÂňÉĹšë╣ň«ÜšÜäÚŁÂŔŤőšÖŻmRNA´╝îš╝║šé╣´╝ÜŠĽłšÄçŔżâńŻÄ´╝îńŞŹÚÇéšöĘń║ÄšáöšęÂŔżâšĘ│ň«ÜšÜäŔŤőšÖŻŔ┤Ę;
´╝ł3´╝ëňťĘŔŤőšÖŻň▒éÚŁóÚÇÜŔ┐çPROTAC ŠŐÇŠť»Ŕ┐ŤŔíîÚŁÂŔŤőšÖŻšÜäňîľňşŽŠĽ▓ÚÖŹ´╝îŔ»ąŠľ╣Š│ĽňůĚŠťëÚźśŠĽłŃÇüňĆ»ÚÇćšÜäń╝śšé╣´╝îň╣ÂńŞöŔâŻňĄčŔ┐ŤŔíîňéČňîľňż¬šÄ»´╝îňĆ»ń╗ąňťĘńŻÄňëéÚçĆńŞőňĆĹŠîąńŻťšöĘ
ŠŹ«š╗čŔ«í´╝îń║║š▒╗ŔŤőšÖŻńŞşŠťëŠÄąŔ┐Ĺ80%ŔŤőšÖŻŠŚáŠśżŔĹŚŠ┤╗ŠÇžńŻŹšé╣´╝îń╝áš╗čńŞŐŔóźŔ«ĄńŞ║Šś»ńŞŹňĆ»ŠłÉŔŹ»ÚŁÂšé╣ŃÇéń╝áš╗čšÜäڣŠáçňĄžÚâĘňłćŠś»ňůĚŠťëŠśÄší«Š┤╗ŠÇžńŻŹšé╣šÜäŔŤőšÖŻ´╝îńŞöÚÇéňÉłš╗ôňÉłň░ĆňłćňşÉ´╝îň╣ÂńŞ╗ŔŽüÚÇÜŔ┐çňŹáŠŹ«Š┤╗ŠÇžńŻŹšé╣šÜäŔŹ»šÉćňşŽńŻťšöĘŠĘíň╝Ć (MOA) ŠŁąŠÄžňłÂŔŤőšÖŻňŐčŔâŻŃÇéŔ┐ÖšžŹŠľ╣Š│ĽŔÖŻšäš«ÇňŹĽ´╝îńŻćŠś»ň╣ÂńŞŹŔâŻň║öšöĘń║ÄŠëÇŠťëšöčšëęڣŠáç´╝îňîůŠőČÚéúń║Ťš╝║ń╣ĆÚůŠ┤╗ŃÇüŠŤżŔóźŔ«ĄńŞ║Šś»ŃÇîńŞŹňĆ»ŠłÉŔŹ»ŃÇŹšÜäڣŠáç´╝îń╗ąňĆŐÚÇÜŔ┐皬üňĆśňĆŹňĄŹŔÇÉŔŹ»ŃÇüšÄ░ڜŠ«ÁŠŚáŔŹ»ňĆ»Š▓╗šÜäڣŠáçŃÇéňŤáŠşĄÚĽ┐Šťčń╗ąŠŁą´╝îÚŁÂňÉĹŔŤőšÖŻšÜäŔŹ»šëęšáöňĆĹňĆŚÚÖÉń║ÄŠťëÚÖÉšÜäŔŤőšÖŻšžŹš▒╗´╝îŠ×üňĄžňť░ÚÖÉňłÂń║ćŔŹ»šëęňĆĹň▒ĽŃÇé
Ŕç¬ŔÇÂÚ▓üňĄžňşŽšÜäCraig CrewsŠĽÖŠÄłňŤóÚśčÚŽľŠČíŠŐąÚüôń║ćň░ĆňłćňşÉPROTACňÉÄšÜäňŹüň╣┤ÚŚ┤´╝îPROTACÚóćňččÚú×ÚÇčňĆĹň▒ĽŃÇéŔŹ»šëęڣŠáçšÜäŠá╝ň▒Çń╣čňŤáŠşĄňĆĹšöčń║ćÚçŹňĄžňĆśňîľ´╝îń╗Äń╝áš╗čŔŹ»šëęڣŠáçŔŻČňÉĹŠŤ┤ňůĚŠîĹŠłśŠÇžšÜäڣŠáçŃÇé
š║ÁŔžéPROTACŠŐÇŠť»ňĆĹň▒ĽňÄćňĆ▓´╝î2001ň╣┤ÚŽľńެPROTACňłćňşÉPROTAC-1Ŕ»×šöč´╝»šö▒PROTACŠŐÇŠť»ňůłÚę▒CrewsňĆŐňůÂňÉîń║őŠŐąÚüô´╝Ť2008ň╣┤´╝îšČČńŞÇńެň░ĆňłćňşÉPROTACŔ»×šöč´╝îňÉîŠáĚšö▒CrewsŔ»żÚóśš╗äŔ«żŔ«íňÉłŠłÉ´╝»šö▒ÚŁÂňÉĹMDM2 E3Š│Ťš┤áŔ┐׊ĹÚůšÜäň░ĆňłćňşÉŠŐĹňłÂňëénutlinňĺîARň░ĆňłćňşÉÚůŹńŻôń╗ąňĆŐńŞşÚŚ┤šÜäPEG LinkerŠ×䊳ɴ╝Ťń╣őňÉÄ´╝îšáöšęÂŔÇůň╝ÇňĆĹňç║ń╗ąCRL4CRBNŃÇüCRL2VHLŃÇücIAPE3Š│Ťš┤áŔ┐׊ĹÚůÂÚůŹńŻôšÜäňÉäšžŹň░ĆňłćňşÉPROTACs´╝ŤňćŹń╣őňÉÄ´╝îArvinasňůČňĆŞšáöňĆĹšÜäARV-110ňĺîARV-471ńŞĄńެPROTACňłćňşÉŔ┐ŤňůąńŞ┤ň║Őň«×Ú¬î´╝îňłćňłźšöĘń║ÄŠ▓╗šľŚňëŹňłŚŔů║šÖîňĺîń╣│Ŕů║šÖîŃÇé

ňŤż´╝ÜPROTACÚçîšĘőšóĹŠŚÂÚŚ┤šé╣
PROTAC ŠŐÇŠť»šÜäňç║šÄ░´╝îń╗ąňůÂÚóáŔŽćŠÇžšÜäŔ«żŔ«íŃÇüÚóáŔŽćŠÇžšÜäńŻťšöĘŠť║ňłÂŠîĹŠłśń║ćŃÇîńŞŹňĆ»ŠłÉŔŹ»ŃǏڣšé╣´╝îńŻ┐ŔÇÉŔŹ»ŠéúŔÇůŔÄĚňżŚŠľ░ńŞÇń╗úŠ▓╗šľŚŔŹ»šëęŃÇéŔ┐ĹńŞĄň╣┤ŠŁą´╝îPROTAC ŠŐÇŠť»Ŕ┐ŤňůąÚźśÚÇčňĆĹň▒ĽÚśÂŠ«Á´╝îńŞ║šöčšëęňî╗ŔŹ»šáöňĆĹň╝ÇŠőôń║ćńŞÇšë犾░šÜäÚóćňččŃÇé
ńŞÇŃÇüŠŐÇŠť»ňÄčšÉćÔÇöÔÇöŠ│Ťš┤áń╗őň»╝šÜäŔŤőšÖŻÚÖŹŔžúš│╗š╗č
ŔŤőšÖŻŔ┤ĘŠś»š╗ćŔâ×ňćůÚçŹŔŽüšÜäšöčšëęňĄžňłćňşÉ´╝îňĆéńŞÄňĄÜšžŹšöčňĹŻŠ┤╗ňŐĘ´╝îňîůŠőČÚůÂňĺîŠ┐Çš┤ášÜäňŐčŔâŻŃÇüŔ┐ÉňŐĘŃÇüŔ┐ÉŔżôŃÇüňůŹšľźňĆŹň║öšşëŃÇéń╗ąňżÇ´╝îń║║ń╗ČÚŁ×ňŞŞňů│Š│ĘŔŤőšÖŻŔ┤ĘňťĘš╗ćŔâ×ňćůŠś»ňŽéńŻĽňÉłŠłÉšÜä´╝îńŻćň»╣ń║ÄŔŤőšÖŻŔ┤ĘňťĘš╗ćŔâ×ňćůŠś»ňŽéńŻĽÚÖŹŔžúšÜäňŹ┤ň░ĹŠťëń║║ňů│Š│ĘŃÇéń╗ąŔë▓ňłŚšžĹňşŽň«ÂAaron CiechanoverŃÇüAvram HershkoňĺîšżÄňŤŻšžĹňşŽň«ÂIrwin RoseňĆĹšÄ░ń║ćŠ│Ťš┤áń╗őň»╝šÜäŔŤőšÖŻŔ┤ĘÚÖŹŔžúŠť║ňłÂ´╝îňů▒ňÉîŔÄĚňżŚń║ć2004ň╣┤Ŕ»║Ŕ┤Łň░öňîľňşŽňąľŃÇé
Š│Ťš┤ኝČŔ║źń╣芜»ńŞÇšžŹňĄÜŔ鯴╝îšö▒76ńެŠ░Ęňč║ÚůŞŠ«őňč║š╗䊳ɴ╝îň║ĆňłŚÚźśň║Žń┐Łň«ł´╝îńŞöňťĘňĄÜšžŹšťčŠáŞšöčšëęńŞşŠÖ«ÚüŹňşśňťĘŃÇéŠ│Ťš┤ášÜäńŞ╗ŔŽüňŐčŔ⯊ś»ŠáçŔ«░ÚťÇŔŽüňłćŔžúšÜäŔŤőšÖŻŔ┤Ę´╝îňŻôŠ│Ťš┤áŔ┐׊Ĺňł░ŔŤőšÖŻńŞŐňÉÄ´╝îń╝Üň»╝Ŕç┤Ŕ┐Öń║ŤŔŤőšÖŻŔóźŔ┐ÉÚÇüňł░ŔŤőšÖŻÚůÂńŻôńŞşŔ┐ŤŔíîÚÖŹŔžú´╝îň«×šÄ░š╗ćŔâ×ňćůŔŤőšÖŻšÜäň╣│ŔííŃÇéŠÇ╗šÜ䊣ąŔ»┤´╝îŠ│Ťš┤áňĆéńŞÄń║ćš╗ćŔâ×ňĹĘŠťčŃÇüňó׊«ľŃÇüňçőń║íŃÇüňłćňîľŃÇüŔŻČšž╗ŃÇüňč║ňŤáŔíĘŔżżŃÇüŔŻČňŻĽŔ░âŔŐéŃÇüń┐íňĆĚń╝áÚÇĺŃÇüŠŹčń╝Ąń┐«ňĄŹŃÇüšéÄšŚçňůŹšľźšşëňçáń╣ÄńŞÇňłçšöčňĹŻŠ┤╗ňŐĘšÜäŔ░âŠÄžŃÇé
Š│Ťš┤áňîľ´╝îńŞ╗ŔŽüšö▒3šžŹÚůÂňéČňîľ´╝îňŹ│E1Š│Ťš┤áŠ┤╗ňîľÚůÂŃÇüE2Š│Ťš┤áš╗ôňÉłÚůÂŃÇüE3Ŕ┐׊ĹÚůÂŃÇéňťĘATPšÜäńŻťšöĘńŞő´╝îŠ│Ťš┤áń╝ÜŔóźŠ┐ÇŠ┤╗´╝îňůłňŻóŠłÉŠ│Ťš┤á-Ŕů║ŔőĚÚůŞňĄŹňÉłšëę´╝îňćŹŔóźŔŻČšž╗ňł░Š│Ťš┤áŠ┤╗ňîľÚůÂE1ńŞŐ´╝ŤÚÜĆňÉÄ´╝îE1ň░ćŠ┤╗ňîľšÜäŠ│Ťš┤áŔŻČšž╗ňł░Š│Ťš┤áš╗ôňÉłÚůÂE2ńŞŐ´╝ŤŠťÇš╗ł´╝îŠ│Ťš┤áŔ┐׊ĹÚůÂE3ň░ćŠ│Ťš┤áŔŻČšž╗ňł░šŤ«ŠáçŔŤőšÖŻńŞŐ´╝îň░▒ňâĆŠś»ŠëôńŞŐÔÇťŠŞůÚÖĄÔÇŁšÜäŠáçšşżŃÇéŔ┐Öń║ŤŔóźŠëôńŞŐŠáçšşżšÜ䚍«ŠáçŔŤőšÖŻ´╝îń╣čń╝ÜŔóźÚÇüňł░ŔŤőšÖŻÚůÂńŻôňĄŹňÉłńŻôňĄäŔ┐ŤŔíîÚÖŹŔžúŃÇé

ňŤż´╝ÜŠ│Ťš┤áňîľšĄ║ŠäĆňŤż
PROTAC´╝łPROteolysis TArgeting Chimeras´╝îŔŤőšÖŻÚÖŹŔžúÚŁÂňÉĹňÁîňÉłńŻô´╝ëšö▒ńŞëšžŹňůâš┤áš╗䊳ɴ╝ÜE3Š│Ťš┤áŔ┐׊ĹÚůÂÚůŹńŻôŃÇüÚŁÂŔŤőšÖŻÚůŹńŻôňĺîLinkerŃÇéE3Š│Ťš┤áŔ┐׊ĹÚůÂÚůŹńŻôŔ┤čŔ┤úšë╣ň╝éŠÇžŠőŤňőčE3Š│Ťš┤áŔ┐׊ĹÚů´╝ŤÚŁÂŔŤőšÖŻÚůŹńŻôšöĘń║ÄÚŁÂňÉĹňĺĽŔÄĚšŤ«ŠáçŔŤőšÖŻ´╝ŤLinkeršöĘń║Äš╗ôňÉłŔ┐ÖńŞĄńެÚůŹńŻô´╝îňŻóŠłÉšĘ│ň«ÜšÜäńŞëňůâňĄŹňÉłšëęŃÇé
PROTACňłćňşÉŔâŻňĄčň░ćE3Š│Ťš┤áŔ┐׊ĹÚůÂňőčÚŤćňł░ڣšé╣ŔŤőšÖŻÚÖäŔ┐Ĺ´╝îńŞ║ڣšé╣ŔŤőšÖŻŠëôńŞŐŠ│Ťš┤áÔÇťŠáçšşżÔÇŁŃÇéňťĘš╗ćŔâ×ńŞş´╝îŠëôńŞŐŠ│Ťš┤áÔÇťŠáçšşżÔÇŁšÜäŔŤőšÖŻň░ćŔóźÚÇüňůąŔŤőšÖŻÚůÂńŻôŔ┐ŤŔíîÚÖŹŔžúŃÇéÚŁÂŔŤőšÖŻÚÖŹŔžúňÉÄ´╝îPROTACňłćňşÉňĆłňĆ»ń╗ąŔóźÚçŐŠöżňç║ŠŁąňĆéńŞÄňł░ńŞőńŞÇńެŔŤőšÖŻšÜäÚÖŹŔžúŔ┐çšĘő´╝îňŤáŠşĄŔ┐ÖšžŹÚÖŹŔžúńŻťšöĘňůĚŠťëňéČňĽłŠ×ť´╝îŔżâň░ĹšÜäŔŹ»šëęňëéÚçĆň░▒ňĆ»ń╗ąň«×šÄ░ÚźśŠĽłšÜäÚÖŹŔžúŃÇé

ňŤż´╝ÜPROTACÚÇÜŔ┐çŠ│Ťš┤áŔ░âŔŐéšÜäŔŤőšÖŻÚÖŹŔžúňĆĹŠîąŔŹ»ŠĽł
šŤ«ň돴╝îš╗ćŔâ×ňćůÚŁÂŔŤőšÖŻŔíĘŔżżŠ░┤ň╣│šÜäŔ░âŠÄžńŞ╗ŔŽüňĆ»ń╗ąń╗ÄńŞëńެň▒éÚŁóŔ┐ŤŔíîň╣▓Úóä:´╝ł1´╝ëňťĘňč║ňŤáň▒éÚŁóŔ┐ŤŔíîÚŁÂŔŤőšÖŻšÜäŔ░âŠÄžŠŐÇŠť»´╝îńżőňŽéŔ┐Ĺň╣┤ňů┤ŔÁĚšÜäňč║ňŤáš╝ľŔżĹŠŐÇŠť»(CRISPR-Cas9)´╝îń╝śšé╣´╝Üš▓żší«ň║ŽÚźśńŞöÚÇÜšöĘŠÇžň╝║šşë´╝îš╝║šé╣´╝ÜńŞŹŔâŻň»╣ÚŁÂŔŤőšÖŻŔ┐ŤŔíîňŐĘŠÇüŔ░âŠÄž´╝îň╣ÂňůĚŠťëńŞŹňĆ»ÚÇćŠÇžń╗ąňĆŐňşśňťĘŠŻťňťĘšÜäÚüŚń╝áŔíąňü┐ŠĽłň║ö;´╝ł2´╝ëňťĘŔŻČňŻĽň▒éÚŁóÚÇÜŔ┐çRNAň╣▓Šë░ŠŐÇŠť»ÚŁÂňÉĹšë╣ň«ÜšÜäÚŁÂŔŤőšÖŻmRNA´╝îš╝║šé╣´╝ÜŠĽłšÄçŔżâńŻÄ´╝îńŞŹÚÇéšöĘń║ÄšáöšęÂŔżâšĘ│ň«ÜšÜäŔŤőšÖŻŔ┤Ę;
´╝ł3´╝ëňťĘŔŤőšÖŻň▒éÚŁóÚÇÜŔ┐çPROTAC ŠŐÇŠť»Ŕ┐ŤŔíîÚŁÂŔŤőšÖŻšÜäňîľňşŽŠĽ▓ÚÖŹ´╝îŔ»ąŠľ╣Š│ĽňůĚŠťëÚźśŠĽłŃÇüňĆ»ÚÇćšÜäń╝śšé╣´╝îň╣ÂńŞöŔâŻňĄčŔ┐ŤŔíîňéČňîľňż¬šÄ»´╝îňĆ»ń╗ąňťĘńŻÄňëéÚçĆńŞőňĆĹŠîąńŻťšöĘ
ńŞëŃÇüPROTACń╝śňŐ┐ňĆŐň╝ÇňĆĹÚÜżšé╣
ńŞÄń╝áš╗čň░ĆňłćňşÉŠő«ŠŐŚňëéšŤŞŠ»ö´╝îPROTACňůĚŠťëńŞÇš│╗ňłŚšőČšë╣šÜäń╝śňŐ┐´╝Ü
´╝ł1´╝ëÚÇëŠőęŠÇžŠŤ┤ÚźśŃÇüńŻťšöĘڣšé╣ŠŤ┤ň╣┐
PROTACŠťÇňĄžšÜäń╝śňŐ┐ń╣őńŞÇŠś»ŔâŻňĄčńŻ┐ڣšé╣ń╗ÄÔÇťńŞŹňĆ»ŠłÉŔŹ»ŠÇžÔÇŁňĆśŠłÉÔÇťňĆ»ŠłÉŔŹ»ŠÇžÔÇŁŃÇéňĄÜŠĽ░ň░ĆňłćňşÉŔŹ»šëꊳľňŹĽŠŐŚÚťÇŔŽüš╗ôňÉłÚůŠłľňĆŚńŻôšÜäŠ┤╗ŠÇžńŻŹšé╣ŠŁąňĆĹŠîąńŻťšöĘ´╝îńŻćŠŹ«ń╝░Ŕ«í´╝îń║║š▒╗š╗ćŔâ×ńŞş80%šÜäŔŤőšÖŻš╝║ń╣ĆŔ┐ÖŠáĚšÜäńŻŹšé╣ŃÇéPROTACŠŚáÚťÇńŞÄšŤ«ŠáçŔŤőšÖŻÚĽ┐ŠŚÂÚŚ┤ňĺîÚźśň╝║ň║ŽšÜäš╗ôňÉł´╝îńż┐ňĆ»ŠŹĽŔÄĚŔŤőšÖŻň╣Âň░ćňůÂÚÖŹŔžú´╝îňŤáŠşĄŠťëŠťŤš¬üšá┤ń╝áš╗čÚÜżń╗ąŠłÉŔŹ»šÜäڣšé╣ň╣ÂňůőŠťŹŔÇÉŔŹ»ŠÇžÚŚ«ÚóśŃÇé
´╝ł2´╝ëňéČňîľÚÖŹŔžúňŐčŔâŻŃÇüŠŤ┤ńŻÄšÜäŔŹ»šëęňëéÚçĆ
ń╝áš╗čšÜäň░ĆňłćňşÉÚççšöĘšÜäŔŹ»šÉćňşŽńŻťšöĘŠĘíň╝ĆńŞ║ňŹáŠŹ«Úę▒ňŐĘŠĘíň╝Ć´╝îńŞ║ń║ćŠĆÉÚźśÚŁÂšé╣ňŹáŠťëšÄç´╝îňżÇňżÇÚťÇŔŽüÚźśňëéÚçĆšÜäŔŹ»šëę´╝îňĆ»ŔâŻń╝ÜňŞŽŠŁąŔżâňĄžšÜ䊻ĺňë»ńŻťšöĘŃÇéPROTACÚççšöĘšÜ䊜»ń║őń╗ÂÚę▒ňŐĘ´╝łevent-driven´╝ëšÜäŔŹ»šÉćňşŽńŻťšöĘŠĘíň╝Ć´╝îňůÂň»╣šŤ«šÜäŔŤőšÖŻšÜäÚÖŹŔžúŔ┐çšĘőŠś»ńŞÇšžŹňéČňîľńŻťšöĘ´╝îňŤáŠşĄňƬڝÇŔżâńŻÄšÜäňîľňÉłšëęŠÁôň║Žńż┐ňĆ»ń╗ąŔżżňł░ňżłňąŻšÜäÚÖŹŔžúŠĽłšÄç´╝îńŞöŔâŻňĄčÚÖŹŔžúŠĽ┤ńެŔŤőšÖŻŃÇé
´╝ł3´╝ëň╗ÂÚĽ┐ńŻťšöĘŠŚÂÚŚ┤
ÚŁÂŔŤőšÖŻšÜäÚÖŹŔžúŠś»ŠŚÂÚŚ┤ńżŁŔÁľŠÇžšÜä´╝îPROTACňĆ»ń╗ąňťĘňçáňłćÚĺčňćůň░ćŔâ×ňćůÚŁÂŔŤőšÖŻŠÂłŔÇŚňł░ŠÄąŔ┐Ĺňč║šíÇŠ░┤ň╣│ŃÇéňŻôňÄčňůłňşśňťĘšÜäÚŁÂŔŤőšÖŻŔÇŚň░ŻňÉÄ´╝îPROTACňƬڝÇÚÖŹŔžúÚ珊ľ░ňÉłŠłÉšÜäÚŁÂŔŤőšÖŻ´╝îňĄžňĄÜŠĽ░ŔŤőšÖŻŔ┤ĘšÜäňćŹňÉłŠłÉÚÇčň║ŽňżłŠůó´╝îňŹ│ńŻ┐ňťĘPROTACň«îňůĘŠŞůÚÖĄňÉÄ´╝îš╗ćŔâ×ňĆ»ŔâŻń╗ŹÚťÇŔŽüńŞÇŠ«ÁšŤŞňŻôÚĽ┐šÜ䊌ÂÚŚ┤´╝îŠëŹŔâŻň░ćŔŤőšÖŻŔ┤ĘŠüóňĄŹŠşúňŞŞšöčšÉćŠ░┤ň╣│´╝îń╗ÄŔÇîňĄžňĄžň╗ÂÚĽ┐ńŻťšöĘŠŚÂÚŚ┤ŃÇé

ŔíĘ´╝ÜPROTACńŞÄňůÂń╗ľŔŹ»šëęň»╣Š»ö
ńŻćPROTACň╝ÇňĆĹÚÜżň║ŽŔżâňĄž´╝«ňëŹňťĘšáöšÜäPROTACňşśňťĘňĆúŠťŹňÉŞŠöÂňĆŐÚÇĆŔ杊ǞŔżâňĚ«šşëÚŚ«ÚóśŃÇéńŞÇŠľ╣ÚŁó´╝îPROTACŔŹ»šëęň▒×ń║ÄňĆîڣšé╣ŔŹ»šëę´╝îňłćňşÉÚçĆŔżâňĄž´╝îš╗ôŠ×äňĄŹŠŁé´╝îŔŹ»ń╗úňŐĘňŐŤňşŽň╣ÂńŞŹń╣ÉŔžé´╝îňĆúŠťŹňÉŞŠöÂňĺîÚÇĆŔ杊ǞňşśňťĘŠîĹŠłś´╝ŤňĆŽńŞÇŠľ╣ÚŁó´╝îPROTACڣŠáçŔŤőšÖŻÚÖŹŔžúŔâŻňŐŤŠśżŔĹŚ´╝îńŻćšö▒ń║ÄÚŁÂŔŤőšÖŻňťĘŠşúňŞŞš╗ćŔâ×ńŞşń╣čń╝ÜŔíĘŔżż´╝îPROTACň»╣ŠşúňŞŞš╗äš╗çšÜ䊻ĺŠÇžÚí╗ň»ćňłçňů│Š│ĘŃÇ銺ĄňĄľ´╝îšöĘń║Äň░ĆňłćňşÉŔŹ»šëꊌꊝ蚺ŤÚÇëšÜäLipinskišÜäÔÇťń║öŠ│ĽňłÖÔÇŁň╣ÂńŞŹÚÇéšöĘń║ÄPROTACÚóćňččŃÇé
šŤ«ňëŹPROTACڣšé╣ńŞ╗ŔŽüňłćńŞ║ňŽéRASŃÇüSHP2šşëÚÜżŠłÉŔŹ»š▒╗šÜäڣšé╣´╝îń╗ąňĆŐBTKŃÇüEGFRÚŁÂňÉĹŠ▓╗šľŚňÉÄňĄŹňĆĹŔÇÉŔŹ»šÜäڣšé╣ŃÇé
a)┬á┬á┬á┬á┬áÚÜżŠłÉŔŹ»ÚŁÂšé╣
 i.    RAS
RASŠś»šÖçńŞşŠťÇňŞŞŔžüšÜ䚬üňĆśňč║ňŤá´╝îňťĘŔé║šÖîŃÇüš╗ôšŤ┤ŔéášÖîňĺîŔâ░Ŕů║šÖîńŞşňŁçňşśňťĘŔ┐çŔíĘŔżżŠłľŠ┤╗ňîľŃÇéňťĘŔóźňĆĹšÄ░ňĺîšáöšęšÜä40ňĄÜň╣┤ŠŁą´╝îńŞÇšŤ┤Š▓튝ëÚĺłň»╣Ŕ»ąÚŁÂšé╣šÜäŔŹ»šëęńŞŐňŞé´╝îÚĽ┐ŠťčŔóźšž░ńŞ║ÔÇťńŞŹňĆ»ŠłÉŔŹ»ÔÇŁšÜäڣšé╣ŃÇéŔÖŻšäÂňÄ╗ň╣┤5Šťłń╗ŻńŞŐňŞéšÜäAMG510´╝łSotorasib´╝ëš╗łš╗ôń║ćŔ»ąÚŁÂšé╣šÜäÔÇťńŞŹňĆ»ŠłÉŔŹ»ŠÇžÔÇŁ´╝îńŻćŠś»ÚÖŹŔžúňëéňťĘŔ»ąÚŁÂšé╣ń╗ŹšäÂňĄžŠťëňĆ»ńŞ║ŃÇé
Úĺłň»╣KRAS-G12Cš¬üňĆś´╝î2020ň╣┤PROTACsŠŐÇŠť»ňůłÚę▒Craig CrewsŠĽÖŠÄłňŞŽÚóćšÜäšáöšęÂň░Ćš╗äÚŽľŠČíŠŐąÚüôń║ćfirst-in-classšÜäňćůŠ║ÉŠÇžKRAS-G12CÚÖŹŔžúňëéLC-2šÜäň╝ÇňĆĹŃÇéšáöšęÂňĆĹšÄ░´╝îLC-2ňĆ»ň┐źÚÇčŃÇüŠîüš╗şňť░ÚÖŹŔžúš║»ňÉłňĺéňÉłš¬üňĆśš╗ćŔâך│╗ńŞşšÜäKRAS-G12C´╝îň»╝Ŕç┤MAPKń┐íňĆĚń╝áň»╝ňĆŚňł░ŠŐĹňłÂ´╝îŔíĘŠśÄPROTACsń╗őň»╝šÜäÚÖŹŔžúŠś»Ŕí░ňçĆšÖîš╗ćŔâ×ńŞşŔç┤šÖîKRASŠ░┤ň╣│ňĺîńŞőŠŞŞń┐íňĆĚšÜäńŞÇšžŹňĆ»ŔíîšşľšĽąŃÇé
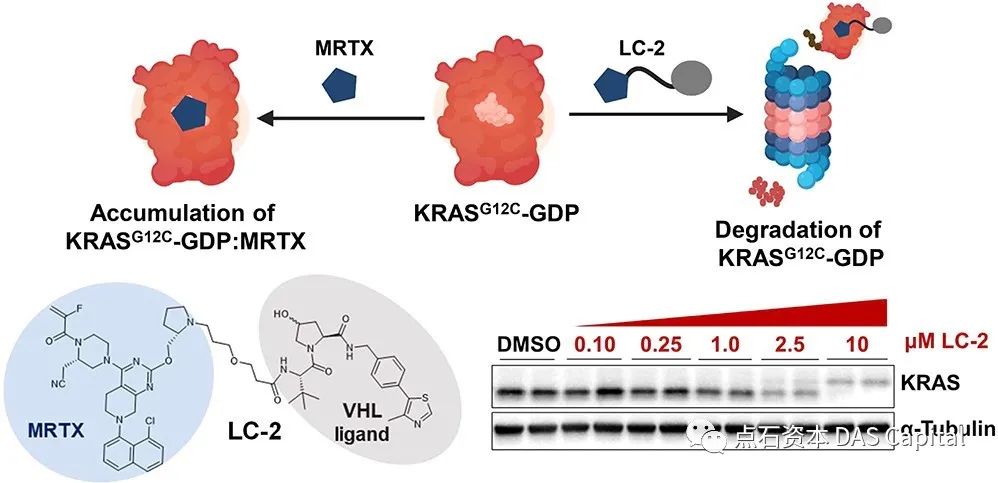
ňŤż´╝ÜÚŽľńެŠłÉňŐčń╗őň»╝ňćůŠ║ÉKRAS G12CÚÖŹŔžúšÜäPROTACňłćňşÉLC-2
Source: ACSCent. Sci. 2020, 6, 8, 1367-1375
ňĆ»ń╗ąÚóäŔžü´╝îňłęšöĘPROTACŠŐÇŠť»Šö╗ňůőšÜäň░ćńŞŹňƬŠś»G12C´╝îň»╣G12DšşëňůÂń╗ľš¬üňĆśń╣čň░ćňĄžŠťëňĆ»ńŞ║ŃÇé
┬áb)┬áŔŹ»šëęň»╝Ŕç┤šÜ䚬üňĆśŔÇÉŔŹ»
ň░ĆňłćňşÉŠŐĹňłÂňë銳ľŠő«ŠŐŚňëéňťĘńŞ┤ň║ŐšöĘŔŹ»Ŕ┐çšĘőńŞş´╝îńŞŹňĆ»Úü┐ňůŹšÜäÚâŻń╝ÜňĆĹšöčŔÄĚňżŚŠÇžŔÇÉŔŹ»ŃÇ銻öňŽéEGFR-T790MňĺîC797SŔÇÉŔŹ»šşëŃÇéŔÖŻšäÂňĆ»ń╗ąÚÇÜŔ┐çň╝ÇňĆĹŠľ░ńŞÇń╗úšÜäŠŐĹňłÂňëéŔžúňć│ŔÇÉŔŹ»ÚŚ«Úóś´╝îńŻćŠś»ÚÜĆšŁÇŠľ░ńŞÇń╗úŔŹ»šëęšÜäńŻ┐šöĘ´╝░šÜäŔÇÉŔŹ»ń╣čń╝ÜÚÜĆń╣őňç║šÄ░ŃÇé
i.     EGFR
EGFR´╝łEpidermal Growth Factor Receptor´╝늜»ńŞŐšÜ«šöčÚĽ┐ňŤáňşÉ´╝łEGF´╝ëš╗ćŔâ×ňó׊«ľňĺîń┐íňĆĚń╝áň»╝šÜäňĆŚńŻô´╝îňł║Š┐ÇńŞőŠŞŞšÜäPI3K/AKTÚÇÜŔĚ»ŃÇüRAS/RAFÚÇÜŔĚ»´╝îň»╣š╗ćŔâךÜäšöčÚĽ┐ŃÇüňó׊«ľŃÇüňłćňîľń║žšöčÚçŹŔŽüńŻťšöĘŃÇé
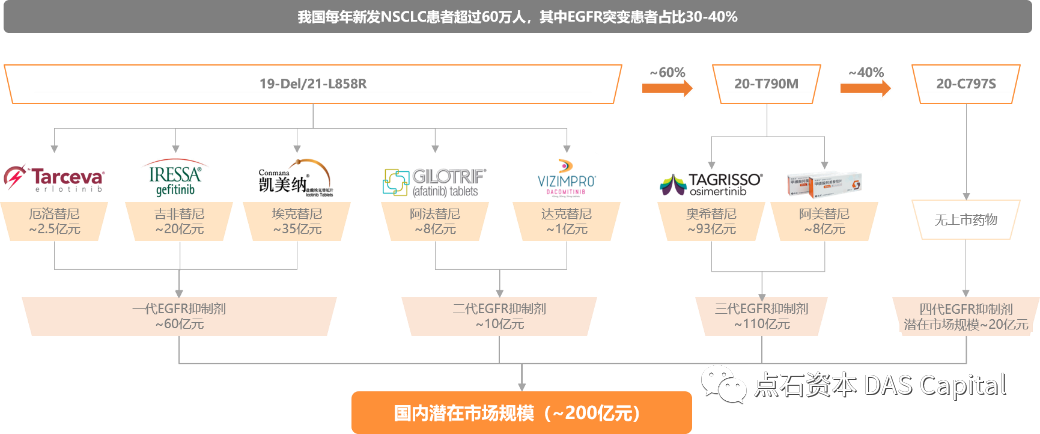
EGFRšÜäŔ┐çň║ŽŔíĘŔżżňĺüňĆśńŞÄÚŁ×ň░Ćš╗ćŔâ×Ŕé║šÖî´╝łNSCLC´╝ëšÜäňĆĹšöčňĆĹň▒Ľň»ćňłçšŤŞňů│´╝îń╣芜»NSCLCÚçŹŔŽüšÜäŔŹ»šëęڣšé╣ń╣őńŞÇŃÇ隍«ňëŹňŤŻňćůňĚ▓ńŞŐňŞéńŞëń╗úEGFRÚŁÂňÉĹŠŐĹňłÂňëé´╝îňîůŠőČ´╝ł1´╝ëšČČńŞÇń╗úEGFRŠŐĹňłÂňëé´╝ÜÚŁÂňÉĹ19-Del/21-L858Rš¬üňĆśšÜäňÄäŠ┤ŤŠŤ┐ň░╝ŃÇüňÉëڣ׊Ť┐ň░╝ŃÇüňčâňůőŠŤ┐ň░╝´╝î´╝ł2´╝ëšČČń║îń╗úEGFRŠŐĹňłÂňëé´╝ÜńŞÄň║ĽšëęńŞŹňĆ»ÚÇćš╗ôňÉłšÜäÚś┐Š│ĽŠŤ┐ň░╝ŃÇüŔżżňůőŠŤ┐ň░╝´╝î´╝ł3´╝ëšČČńŞëń╗úEGFRŠŐĹňłÂňëé´╝ÜňťĘÚŁÂňÉĹ19-Del/21-L858Rš¬üňĆśšÜäňč║šíÇńŞŐňÉÂÚŁÂňÉĹ20-T790Mš¬üňĆśšÜäňąąňŞîŠŤ┐ň░╝ňĺîÚś┐šżÄŠŤ┐ň░╝ŃÇéńŻć15%~32%šÜäŠéúŔÇůń╝ÜňĆĹšöčšČČńŞëŠČíEGFRš¬üňĆś´╝îň╣ŠťÇňŞŞňĆĹšöčňťĘEGFR C797SńŻŹšé╣´╝îňŹ│ňąąňŞîŠŤ┐ň░╝ńŞÄEGFRšÜäš╗ôňÉłńŻŹšé╣ŃÇé
ÚŁóň»╣C797SńŻŹšé╣š¬üňĆś´╝«ňëŹńŞ┤ň║ŐńŞŐň░ÜňĄäń║ÄŠŚáŔŹ»ňĆ»Š▓╗šŐŠÇüŃÇéŔÇîňłęšöĘPROTACŠŐÇŠť»ň╝ÇňĆĹšÜäEGFRÚŁÂňÉĹŔŤőšÖŻÚÖŹŔžúňłćňşÉŠťëŠťŤňŞŽŠŁąňĚĘňĄžńŞ┤ň║ŐŔÄĚšŤŐŃÇé
šŤ«ň돴╝Ĺń╗ČŠ»Ćň╣┤Šľ░ňĆĹÚŁ×ň░Ćš╗ćŔâ×Ŕé║šÖîŠéúŔÇůń║║ŠĽ░ŔÂůŔ┐ç60ńŞçń║║´╝îňůÂńŞşŠÉ║ňŞŽEGFRš¬üňĆśšÜäŠéúŔÇůňŹáŠ»öÚźśŔżż40%ŃÇéŠá╣ŠŹ«ň╝ŚŔőąŠľ»šë╣Š▓ÖňłęŠľçŠĽ░ŠŹ«´╝î2019ň╣┤ńŞşňŤŻEGFR-TKI ŔŹ»šëęňŞéňť║ňĚ▓š╗ĆŠÄąŔ┐Ĺ80ń║┐ňůâń║║Š░ĹňŞü´╝îÚóäŔ«í2022ň╣┤ńŞşňŤŻEGFR-TKI ŔŹ»šëęňŞéňť║ŔžäŠĘíň░ćŔÂůŔ┐ç200ń║┐´╝îCAGRń┐ŁŠîü30%ń╗ąńŞŐŃÇé
ŔíĘ´╝ÜÚŁ×ň░Ćš╗ćŔâ×Ŕé║šÖîEGFRňŞéňť║ŔžäŠĘíŠÁőš«Ś
ŠĽ░ŠŹ«ŠŁąŠ║É´╝Üšé╣šč│ŠĽ┤šÉć
Craig M. CrewsŃÇüÚçĹňüąŃÇüň╝áńŞëňąçŃÇüńŞüňůőšşëŔ»żÚóśš╗äÚ⯊ťëšŤŞňů│EGFR-PROTACsšÜäšáöšę´╝îšáöšęÂń║║ňĹśň░ćšČČńŞÇŃÇüń║îŃÇüńŞëń╗úŠŐĹňłÂňëéńŻťńŞ║š╗ôňÉłÚŁÂŔŤőšÖŻEGFRšÜäÚůŹńŻôň║öšöĘňł░PROTACšÜäŔ«żŔ«íńŞş´╝ĘňťĘÚÇÜŔ┐çŔŤőšÖŻÚÖŹŔžúÚÇöňżäňůőŠťŹŔÇÉŔŹ»š¬üňĆśŠłľŠëżň»╗š¬üšá┤ŠŐĹňłÂňëéšÜäŔŤőšÖŻÚÖŹŔžúšľŚŠ│ĽŃÇéPROTACšľŚŠ│ĽšÜäň║öšöĘ´╝늝ŤŔžúňć│šöĘŔŹ»ňÉÄEGFRń║žšöčŠČíš║žš¬üňĆśšÜäÚŚ«Úóś´╝îňçĆň░ĹŔÇÉŔŹ»ňĆĹšöč´╝îňÉÂŔâŻňĄčÚźśŠĽłÚŁÂňÉĹňĄÜšžŹEGFRš¬üňĆś´╝┐ń╗úńŞÇŃÇüń║îŃÇüńŞëń╗úEGFRń╝áš╗čň░ĆňłćňşÉŠŐĹňłÂňëé´╝îŠÄĘŔíîŔç│ńŞÇŃÇüń║îš║┐Š▓╗šľŚŠľ╣ŠíłŃÇé
Úĺłň»╣EGFRňĄÜš¬üňĆśPROTACŔŹ»šëęšÜäšáöňĆĹň╣ÂńŞŹň«╣Šśô´╝îšö▒ń║ÄńŻŹšé╣ÚÇëŠőꊝëÚÖÉŃÇüň»╣ÚÇëŠőęŠÇžńŞÄň«ëňůĘŠÇžšÜäňĆľŔłŹŃÇüňÉłŠłÉňĚąŔë║ňĄŹŠŁéšşëňĄÜŠľ╣ÚŁóňŤáš┤áňłÂš║Ž´╝«ňëŹňůĘšÉâň░ÜŠŚáń║žňôüŔ┐ŤňůąńŞ┤ň║ŐڜŠ«ÁŃÇéC4 TherapeuticsŠşúňťĘň╝ÇňĆĹšÜäňÇÖÚÇëŔŹ»šëęCFT8919ÚŁÂňÉĹEGFR L858Rš¬üňĆśšÜäňĆśŠ×äńŻŹšé╣´╝îńŞ┤ň║Őň돊Ľ░ŠŹ«ŠśżšĄ║ňůÂŔ⯊śżŔĹŚňçĆň░ĹEGFRŠČíš║žš¬üňĆś´╝îń╗ÄŔÇîňçĆň░ĹŔÇÉŔŹ»ňĆĹšöč´╝îŔ»ąŔŹ»šëęň»╣C797SňĺîT790Mš¬üňĆśňÉîŠáĚňůĚŠťëŠ┤╗ŠÇž´╝îň╣ÂňůĚŠťëňůąŔäĹŔâŻňŐŤ´╝늝Ťň»╣ŔäĹŔŻČšž╗Ŕé┐šśĄŠťëŠĽłŃÇéňůČňĆŞŔ«íňłĺ2022ň╣┤ńŞşšö│ŠŐąIND´╝î2022ň╣┤ň║Ľň╝ÇňÉ»ńŞ┤ň║ŐŔ»ĽÚ¬îŃÇé
ii.     BTK
BTKŠ┐ÇÚůŠś»BCRń┐íňĆĚÚÇÜŔĚ»šÜäňů│Úö«ŔŤőšÖŻ´╝îň»╣Bš╗ćŔâךÜäňó׊«ľŃÇüňşśŠ┤╗ňůĚŠťëÚçŹŔŽüńŻťšöĘŃÇéBTKŔŤőšÖŻš╝║ňĄ▒ń╝Üň»╝Ŕç┤ŠłÉšćčBš╗ćŔâ׊ŚáŠ│Ľń║žšöčŃÇéń╝ŐňŞâŠŤ┐ň░╝ńŻťńŞ║ÚŽľńެńŞŐňŞéšÜäBTKŠŐĹňłÂňëé´╝îń║Ä2013ň╣┤ňťĘšżÄňŤŻńŞŐňŞéňÉÄ´╝îńŞÇň╣┤ňćůńż┐ŠłÉńŞ║ÚöÇňö«ÚóŁňó×ÚĽ┐ŠťÇň┐źšÜäŠŐŚŔé┐šśĄŔŹ»šëęń╣őńŞÇŃÇéńŻćŠś»´╝îIbrutinibń╣čňşśňťĘńŞĄńެŠśÄŠśżšÜäň╝▒šé╣´╝ÜńŞÇŠľ╣ÚŁóŠś»off-targetň»╝Ŕç┤šÜäňë»ńŻťšöĘ´╝ŤňĆŽńŞÇŠľ╣ÚŁóŠś»BTKšÜ䚬üňĆśńŻôC481Sň»╝Ŕç┤šÜäŔÇÉŔŹ»ŃÇé
BTKń╗ÄńŞÇń╗úŠŐĹňłÂňëéňł░šÄ░ňťĘšÜäń║îń╗úŠŐĹňłÂňëé´╝îŔÖŻšäÂŔŹ»ŠĽłÚâŻÚŁ×ňŞŞŠśÄŠśż´╝îńŻćŠ×üŠśôń║žšöčŔÇÉŔŹ»ŃÇéń╗ąńŞÇń╗úBTKŠŐĹňłÂňëéńŞ║ńżő´╝Ć24ň░ĆŠŚÂńż┐ŠťëšŚůń║║šÜäBTKŔŤőšÖŻŠ░┤ň╣│ŠüóňĄŹňł░Š▓╗šľŚň돚Üä3%Ŕç│30%ń╗ąńŞŐŃÇé
ňŤáŠşĄ´╝îńŞ┤ň║ŐŠÇąÚťÇŔâŻňĄčňůőŠťŹBTKš¬üňĆśŔÇÉŔŹ»ńŞöňůĚŠťëŠŤ┤ň░Ćňë»ńŻťšöĘšÜäŔŹ»šëęŃÇéÚççšöĘPROTACŠŐÇŠť»´╝îńŞÇŠś»ňŤáńŞ║ň«âšÉćŔ«║ńŞŐňĆ»ń╗ąňż¬šÄ»ňłęšöĘ´╝îňŻôPROTACŔ┐Ťňůąš╗ćŔâ×ňÉÄ´╝îňĆ»ń╗ąŠîüš╗şňť░ÚÖŹŔžúŠľ░šö芳ľňÄ芝ëšÜäBTKŔŤőšÖŻ´╝ŤšČČń║î´╝îňƬŔŽüńżŁŔÁľBTK´╝áŔ«║Šś»ŠÇÄŠáĚšÜäš╗ôňÉłŠľ╣ň╝Ć´╝îÚÖŹŔžúń╣őňÉÄ´╝îňůÂń╗ľšÜäńŻťšöĘŠť║ňłÂÚ⯊ŚáŠ│ĽŔÁĚńŻťšöĘŃÇé
ń║öŃÇüňŤŻňćůňĄľšŤŞňů│ń╝üńŞÜ
´╝łńŞÇ´╝ë┬á┬á┬á ŠÁĚňĄľ

Arvinasšö▒CrewsňťĘ2013ň╣┤ňłŤšźő´╝»ŠťÇŠŚęňŞâň▒ÇPROTACšÜäňůČňĆŞń╣őńŞÇ´╝îň╝ÇňĆĹšÜäŔŤőšÖŻÚÖŹŔžúŠŐÇŠť»ńŞ╗ŔŽüšöĘń║ÄŔé┐šśĄňĺך╗Ćš│╗š╗čš▒╗šľżšŚůšÜäŠ▓╗šľŚŃÇ隍«ň돴╝îňůČňĆŞňĚ▓ŠťëńŞĄŠČżPROTACŔŹ»šëęŔ┐ŤňůąńŞ┤ň║ŐIIŠťč´╝îňłćňłźŠś»ÚŁÂňÉĹÚŤäŠ┐Çš┤áňĆŚńŻô´╝łAR´╝ëšÜäARV-110ňĺîÚŁÂňÉĹÚŤîŠ┐Çš┤áňĆŚńŻô´╝łER´╝ëšÜäARV-471ŃÇé
2021ň╣┤7ŠťłŔżëšĹ×ńŞÄArvinasŔżżŠłÉňŹĆŔ««´╝îňů▒ňÉîň╝ÇňĆĹň╣ÂňĽćńŞÜňîľARV-471ŃÇéŠá╣ŠŹ«ňŹĆŔ««´╝îArvinasň░ćŔÄĚňżŚ6.5ń║┐šżÄňůâšÜäÚóäń╗śŠČż´╝îń╗ąňĆŐňĄÜŔżż14ń║┐šżÄňůâšÜäÚçîšĘőšóĹń╗śŠČż´╝îŔżëšĹ×Ŕ┐śň░ćň»╣ArvinasŔ┐ŤŔíî3.5ń║┐šżÄňůâšÜäŔé튣âŠŐĽŔÁäŃÇéÚÖĄŔżëšĹ×ňĄľ´╝îArvinasŔ┐śńŞÄÚ╗śŠ▓ÖńŞťŃÇüňč║ňŤáŠ│░ňůőŃÇüŠőťŔÇ│šşëňłÂŔŹ»ňĚĘňĄ┤ň╗║šźőń║ćňÉłńŻťňů│š│╗ŃÇé
C4 Therapeuticsšö▒James BradnerŠłÉšźőń║Ä2015ň╣┤´╝îŔ»ąňůČňĆŞŠőąŠťëńŞôŠ│Ęń║ÄŔŤőšÖŻÚÖŹŔžúňëéň╝ÇňĆĹšÜäň╣│ňĆ░C4T TORPEDO´╝îšöĘń║ÄPROTACšÜäŔ«żŔ«íŃÇüňÉłŠłÉňĺîŠ┤╗ŠÇžŔ»äń╗Ě´╝ĘňťĘňĆĹšÄ░ÚźśŔ┤ĘÚçĆšÜäŔŤőšÖŻÚÖŹŔžúňëéŃÇé
šŤ«ňëŹňŞâň▒ÇšÜäڣšé╣ńŞÄŔé┐šśĄšŤŞňů│´╝îňŽéIKZF1/3ŃÇüBRD9ŃÇüEGFRŃÇüBRAF-V600EňĺîRETšşëŃÇé2019ň╣┤1Šťł´╝îC4 TherapeuticsńŞÄŠŞĄňüąňĺŚŠ░ĆňłćňłźŔżżŠłÉ4.15ń║┐šżÄňůâňĺî9ń║┐šżÄňůâšÜäňÉłńŻťňŹĆŔ««ŃÇé
Kymera TherapeuticsŠłÉšźőń║Ä2016ň╣┤´╝îńŞôŠ│Ęń║ÄšöĘŔŤőšÖŻÚÖŹŔžúŠŐÇŠť»Š▓╗šľŚšÖçňĺîňůŹšľźŠÇžšéÄšŚç´╝îň╗║šźőń║ćšőČšë╣šÜäPegasusň╣│ňĆ░´╝îŔ»ąň╣│ňĆ░ňĆ»ňłęšöĘšöčšëęń┐íŠü»ňşŽÚę▒ňŐĘڣŠáçšÜäňĆĹšÄ░ŃÇüň╗║šźőšÜäE3Ŕ┐׊ĹÚůÂň║ôŃÇüŠőąŠťëňůłŔ┐ŤšÜäŔŤőšÖŻÚÖŹŔžúŠúÇŠÁőŠëőŠ«ÁňĺîÚźśŠ░┤ňçćšÜäš╗ôŠ×äšöčšëęňşŽŠĘíň×őŃÇéňŞâň▒ÇšÜäڣšé╣ŠťëIRAK4ŃÇüSTAT3šşë´╝îŔ┐Ťň▒ĽŠťÇň┐źšÜ䊜»KT-474´╝«ňëŹňťĘIŠťčńŞ┤ň║ŐŃÇé
Ŕ»ąňůČňĆŞšÜäňÉłńŻťń╝Öń╝┤ńŞ╗ŔŽüŠś»ŔÁŤŔ»║ŔĆ▓ňĺîŔĹŤňů░š┤áňĆ▓ňůőšşëŃÇé2020ň╣┤7Šťł´╝îńŞÄŔÁŤŔ»║ŔĆ▓ŔżżŠłÉňĄÜÚí╣Ŕ«íňłĺšÜ䊳śšĽąňÉłńŻť´╝îŔÄĚňżŚ1.5ń║┐šżÄňůâšÜäÚóäń╗śŠČż´╝îň╣ÂňĆ»ŔâŻŔÄĚňżŚŔÂůŔ┐ç20ń║┐šżÄňůâšÜ䊯ťňťĘň╝ÇňĆĹŃÇüšŤĹš«íňĺîÚöÇňö«ÚçîšĘőšóĹ´╝îń╗ąňĆŐňĆ»ŔžéšÜäšë╣Ŕ«ŞŠŁâńŻ┐šöĘŔ┤╣ŃÇé
´╝łń║î´╝ë┬á ┬á ňŤŻňćů
ň╝ÇŠőôŔŹ»ńŞÜ´╝ł9939.HK´╝늳ɚźőń║Ä2009ň╣┤´╝îń╗ąÚŤäŠ┐Çš┤áňĆŚńŻô(AR)ňĺîŔé┐šśĄšŤŞňů│šľżšŚůńŞ║ŠáŞň┐â´╝îšáöňĆĹňĄÜÚÇÜÚüôń║žňôüš╗äňÉł´╝îń║žňôüŔŽćšŤľňůĘšÉâÚźśňĆĹšŚůšÄçšÖçŃÇüŠľ░ňćáŃÇüŔä▒ňĆĹňĺĄšľ«šşëŃÇé2021ň╣┤2Šťł´╝îň╝ÇŠőôŔŹ»ńŞÜň«úňŞâňůÂŔç¬ńŞ╗šáöňĆĹšÜäňůĘšÉâÚŽľńެňč║ń║ÄPROTACŠŐÇŠť»šÜäňĄľšöĘARÚÖŹŔžúňëé´╝łGT20029´╝ëšÜäINDšö│Ŕ»ĚňĚ▓ŔÄĚňŤŻň«ÂŔŹ»ňôüšŤĹšŁúš«íšÉćň▒ÇňĆŚšÉćŃÇéŔ»ąňůČňĆŞň░ćÚÇÜŔ┐çň╝ÇňĆĹÚŁ×ňĆúŠťŹšÜäPROTACŔŹ»šëꊣąÚ¬îŔ»üŔ┐ÖńŞÇň╝ÇňłŤŠÇžšÜäŠŐÇŠť»Šś»ňÉŽňĆ»ń╗ąŠłÉŔŹ»´╝îňÉÂń╣芺úňťĘšáöňĆĹňĆúŠťŹšÜäÚŁÂňÉĹARšÜäPROTAC´╝îÚÇéň║öŔ»üńŞ║ÚŤäŠ┐Çš┤áŠÇžŔä▒ňĆĹňĺĄšľ«šşëŃÇé
ŠÁĚŠÇŁšžĹ´╝ł002653´╝늳ɚźőń║Ä2000ň╣┤´╝îňůČňĆŞňůĚŠťëŠ»öŔżâň«îňľäšÜäPROTACň╣│ňĆ░´╝îšöĘń╗ąň╝ÇňĆĹÚĺłň»╣Ŕé┐šśĄňĺîŔç¬Ŕ║źňůŹšľźŠÇžšľżšŚůšÜäÚźśÚÇëŠőęŠÇžńŞöňĆúŠťŹŠťëŠĽłšÜäŔŤőšÖŻÚÖŹŔžúŔŹ»šëęŃÇ隍«ňëŹPROTACšÜäÚí╣šŤ«ŠťëŔÂůŔ┐ç20ńެ´╝îňŞâň▒ÇšÜäڣšé╣ŠťëBTKŃÇüIRAK4ŃÇüBRD4ŃÇüARŃÇüEGFRŃÇüKRASŃÇüALKŃÇüCDK4/6ŃÇüEZH2ŃÇüPARPŃÇüBcr/AblŃÇüSTAT3šşëŃÇé
2017ň╣┤´╝îňĺîňżäňî╗ŔŹ»ňťĘńŞŐŠÁĚšžĹŠŐÇňĄžňşŽňćůŠłÉšźő´╝îňůČňĆŞŔ»×šöčń╣őňłŁň░▒ŔÄĚňżŚń║抣ąŔç¬ŔüöňĺîŔÁ䊝ČŃÇüŔŹ»ŠśÄň║ĚňżĚŃÇüňćŹÚ╝Äňî╗ŔŹ»ŃÇüňŹâÚ¬ąŔÁ䊝ȚÜäŠŐĽŔÁä´╝î2018ň╣┤ňĆłň«úňŞâŠÉ║ŠëőńŞŐŠÁĚšžĹŠŐÇňĄžňşŽňÉłńŻťň╝ÇňĆĹÔÇťÚůŹńŻôň»╝ňÉĹŔŤőšÖŻŔ┤ĘÚÖŹŔžúŔŹ»šëęÔÇŁ´╝îň╣ÂŔżżŠłÉń║ćÚÇżńŞÇń║┐šżÄÚçĹšÜ䊳śšĽąňÉłńŻťňŹĆŔ««ŃÇéňůČňĆŞÚÇÜŔ┐çńŞÄńŞŐŠÁĚšžĹŠŐÇňĄžňşŽšÜäÚí╣šŤ«ňÉłńŻťŔÁĚŠşą´╝îňťĘŠëęňĄžń║žňôüš«íš║┐šÜäňÉŠşúňťĘňŐ¬ňŐŤŠëôÚÇáŔç¬ňĚ▒šőČšë╣šÜ䊾░ŔŹ»šáöňĆĹň╣│ňĆ░ŃÇé
ňĺîňżäňî╗ŔŹ»šÜäPROTACň╣│ňĆ░ŔÁĚŠşąŔżâŠŚę´╝îšČČńŞÇńެPROTACňÉłńŻťÚí╣šŤ«ňĚ▓š╗ĆšáöňĆĹŔÂůŔ┐ç3ň╣┤ŠŚÂÚŚ┤´╝«ňëŹňĚ▓šşŤÚÇëňç║ń║ćňůĚŠťëÚźśŠłÉŔŹ»ŠÇžšÜäňłćňşÉš│╗ňłŚ´╝îŔ┐Ťň▒ĽŔżâň┐źšÜäňłćňşÉňŹ│ň░ćň╝Çň▒ĽIND-EnablingŃÇéŔ»ąňłćňşÉš│╗ňłŚňůĚŠťëÚźśňĆúŠťŹšöčšëęňłęšöĘň║Ž´╝îň╣ÂňťĘňŐĘšëęńŻôňćůŔŹ»ŠĽłŠśżŔĹŚ´╝îňťĘňůőŠťŹÚŁ×ň░Ćš╗ćŔâ×Ŕé║šÖîň░ĆňłćňşÉŔŹ»šëęŔÇÉŔŹ»šşëÚóćňččňĄäń║ÄÚóćňůłňť░ńŻŹŃÇé
šĆâŔ»║šöčšëꊳɚźőń║Ä2018ň╣┤´╝»ńŞÇň«ÂńŞôŠ│Ęń║Äň░ĆňłćňşÉňłŤŠľ░ŔŹ»šáöňĆĹšÜäšöčšëęňî╗ŔŹ»ń╝üńŞÜŃÇéňůČňĆŞńŞôŠ│Ęń║Äň╝ÇňĆĹňłćňşÉń╝┤ńżúń╗őň»╝šÜäŔŤőšÖŻŔ┤ĘÚÖŹŔžú´╝łChaperone-mediated Protein Degradation/Degrader, CHAMPTM´╝ëŠŐÇŠť»ň╣│ňĆ░´╝«ňëŹňĚ▓ŠťëňĄÜńެňůĘšÉâňłŤŠľ░šÜ䊾░ńŞÇš▒╗ň░ĆňłćňşÉŠŐŚŔé┐šśĄňîľňÉłšëęňŹ│ň░ćŔ┐ŤňůąńŞ┤ň║ŐŠłľňĄäń║ÄńŞ┤ň║ŐňëŹň╝ÇňĆĹڜŠ«ÁŃÇé
ńŻťńŞ║ÚŁęňĹŻŠÇžŠŐÇŠť»´╝îPROTACšÜäňĆĹň▒Ľš╗ĆňÄćń║ć20ň╣┤´╝îň░ĄňůÂňťĘŔ┐çňÄ╗šÜä5ň╣┤ňĆĹň▒ĽŔ┐ůšîŤ´╝îń┐ĘšäÂňĚ▓š╗ĆŠłÉńŞ║Šľ░ŔŹ»šáöňĆĹšÜ䊾░ÚúÄňĆúŃÇéňłęšöĘŔ»ąŠŐÇŠť»ňĆ»ňŞâň▒ÇšÜäڣšé╣ň╣┐Úśö´╝îňŞéňť║ňĚĘňĄž´╝¬ŠŁąňĆ»ŠťčŃÇéńŻćŠś»PROTACňłćňşÉÚçĆňĄžŃÇüšöčšëęňłęšöĘň║ŽňĚ«ŃÇüŠłÉŔŹ»ňŤ░ÚÜżšÜ䚌Ťšé╣ń╣čňżłŠśÄŠśż´╝čňżůŔ»ąŠŐÇŠť»šÜäńŞŹŠľşŔ┐ŤŠşąňĺîň«îňľäŃÇ隍Şń┐íÚÜĆšŁÇŠłÉŔŹ»ŠÇžňĚ«šÜäÚÜżÚóśŔóźŠö╗ňůő´╝îPROTACňĆ»ń╗ąŠłÉńŞ║ňâĆň░ĆňłćňşÉŠŐĹňłÂňëéŃÇüňŹĽŠŐŚňĺîňůŹšľźŠ▓╗šľŚšşëńŞÇŠáĚŠłÉňŐčšÜäšľŚŠ│ĽŃÇéňŻôšä´╝îń╣芝čňżůšťőŔžüŠŤ┤ňĄÜPROTACŔŹ»šëęńŞŐňŞé´╝îň╗ÂÚĽ┐ŠéúŔÇůšöčňĹŻň╣ŠĆÉÚźśŠéúŔÇůšÜäšöčňşśŔ┤ĘÚçĆŃÇé
ňůŹŔ┤úňú░ŠśÄ
šŤŞňů│ňćůň«╣ňč║ń║ÄňĚ▓ňůČň╝ÇšÜäŔÁ䊾֊łľń┐íŠü»Šĺ░ňćÖ´╝îńŻćŠťČňůČňĆŞńŞŹń┐ŁŔ»üŔ»ąšşëń┐íŠü»ňĆŐŔÁ䊾֚Üäň«îŠĽ┤ŠÇžŃÇüňçćší«ŠÇž´╝îŠëÇňÉźń┐íŠü»ňĆŐŔÁ䊾Öń┐ŁŠîüňťĘŠťÇŠľ░šŐŠÇüŃÇéňÉ´╝ČňůČňĆŞŠťëŠŁâň»╣ŠťČŠŐąňĹŐŠëÇňÉźń┐íŠü»ňťĘńŞŹňĆĹňç║ÚÇÜščąšÜäŠâůňŻóńŞőňüÜňç║ń┐«Šö╣´╝îÚśůŔ»╗ŔÇůň║öňŻôŔç¬Ŕíîňů│Š│ĘšŤŞň║öšÜ䊍┤Šľ░Šłľń┐«Šö╣ŃÇé
ňťĘń╗╗ńŻĽŠâůňćÁńŞő´╝Ț»çŠľçšźáńŞşšÜäń┐íŠü»ŠłľŠëÇŔíĘŔ┐░šÜäŠäĆŔžüňŁçńŞŹŠ×䊳Éň»╣ń╗╗ńŻĽń║║šÜäŠŐĽŔÁäň╗║Ŕ««´╝áŔ«║Šś»ňÉŽňĚ▓š╗ĆŠśÄšĄ║ŠłľŠÜŚšĄ║´╝ȊչňĹŐńŞŹŔâŻńŻťńŞ║Úüôń╣ëšÜäŃÇüŔ┤úń╗╗šÜäňĺîŠ│ĽňżőšÜäńżŁŠŹ«ŠłľŔÇůňçşŔ»üŃÇéňťĘń╗╗ńŻĽŠâůňćÁńŞő´╝ČňůČňĆŞń║ŽńŞŹň»╣ń╗╗ńŻĽń║║ňŤáńŻ┐šöĘŠťČŠľçšźáńŞşšÜäń╗╗ńŻĽňćůň«╣ŠëÇň╝ĽŔç┤šÜäń╗╗ńŻĽŠŹčňĄ▒Ŕ┤čń╗╗ńŻĽŔ┤úń╗╗ŃÇ銝Ȋľçšźáń╗ůńŞ║ŠťČňůČňĆŞŠëÇŠťë´╝¬š╗Ćń║őňůłń╣ŽÚŁóŔ«ŞňĆ»´╝îń╗╗ńŻĽŠť║Š×äňĺîńެń║║ńŞŹňżŚń╗ąń╗╗ńŻĽňŻóň╝Ćš┐╗šëłŃÇüňĄŹňłÂŃÇüňĆĹŔíĘŃÇüŔŻČňĆĹŠłľň╝ĽšöĘŠťČŠŐąňĹŐšÜäń╗╗ńŻĽÚâĘňłćŃÇé











![]()