

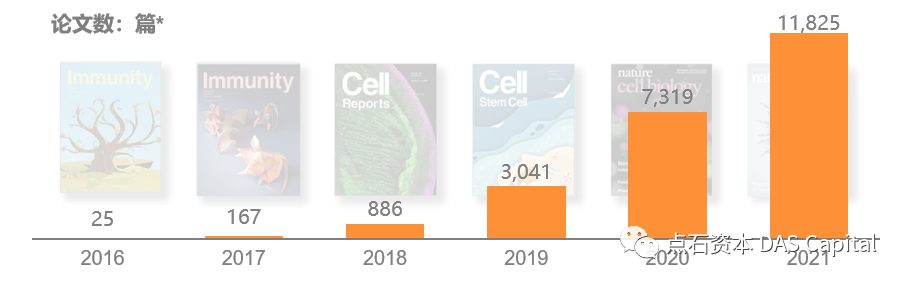
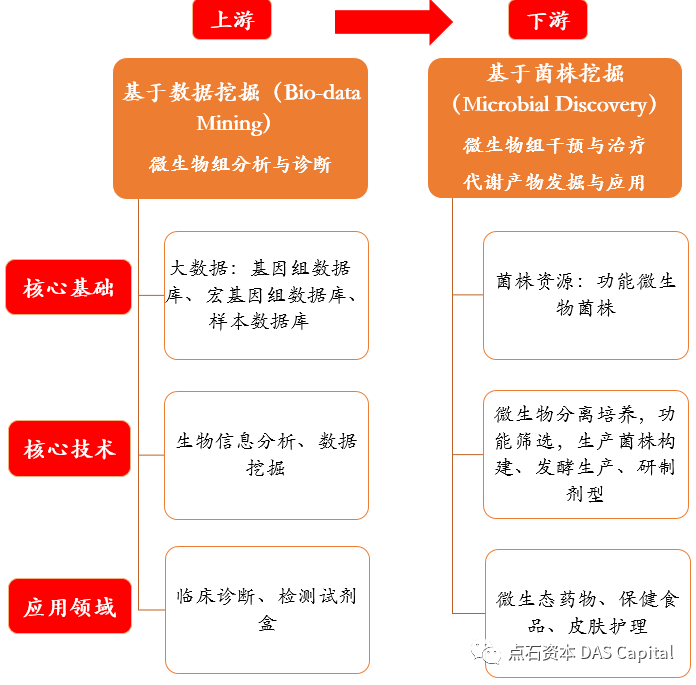
ÔÇťŠ░¬ÚçĹňůÜÔÇŁŠîçňťĘŠŞŞŠłĆńŞşňůůňÇ╝šÜäšÄęň«Â´╝îÚÇÜŔ┐çŔ┤şń╣░ŔúůňĄçŃÇüŔÁäŠ║É´╝îň┐źÚÇčŠĆÉňŹçŠłśňŐŤŃÇéÚéúňŽéŠ×ťŠ░¬ÚçĹň░▒ŔâŻňĆĹÚźśňłćŠľçšźá´╝ëňĄÜň░Ĺń║║ń╝ÜšÄ░ňť║Šëźšáü´╝čňŹĽš╗ćŔâ׊Áőň║Ćň░▒Šś»Ŕ┐ÖŠáĚńŞÇńެŠŚáÚÖÉŠÄąŔ┐ĹÔÇťň╝ÇŠîéÔÇŁšÜäń╗śŔ┤╣ÚüôňůĚ´╝îšöĘ10xň╣│ňĆ░ňüÜńŞÇńެŠáĚŠťČÚťÇŔŽüŔŐ▒Ŕ┤╣3ńŞçňůâ´╝îń╗ů2021ň╣┤Š░¬ÚçĹ10xšÜ䊾皟áň░▒Ŕ┐Ĺ12,000š»çŃÇé2016-2020Ŕ┐Öń║öň╣┤ÚŚ┤´╝îňů▒2,357š»çňŹĽš╗ćŔâ×ŔŻČňŻĽš╗äŠÁőň║ĆŠľçšźášÖ╗ńŞŐń║ćTop50ŠťčňłŐ´╝îňůëŃÇŐCellŃÇőň░▒ŠľęŔÄĚ100ňĄÜš»çŃÇé
ň░Żš«íŠ»Ćň╣┤Ŕ»×šöčňçáńŞçš»çŠľ░šÜäňĆĹšÄ░´╝îňŹĽš╗ćŔâ׊Áőň║Ćń╗ŹňĄäń║ÄŠ░¬ÚçĹňůÜšÜäšőéŠČóŠŚÂÚŚ┤´╝îňĄÜŠĽ░ň«×Ú¬îň«ĄŃÇüŔŹ»šáöń╝üńŞÜń╣âŔç│ňî╗ÚÖóŠŚáŠ│ĽňĄžŔžäŠĘíńŻ┐šöĘŃÇéňŤáňż¬ŠĽůńżő´╝îňĆéŔÇâń║║ňĚąŠÖ║ŔâŻňĆĹň▒Ľ´╝îÚÜĆšŁÇš«ŚŠ│Ľń╝śňîľŃÇüAIŔŐ»šëçšáöňĆĹ´╝îAI trainingŠłÉŠťČŠ»Ćň╣┤ń╗ą10ňÇŹÚÇčň║ŽńŞőÚÖŹ´╝îňŞŽŠŁąšÜ䊜»AIňŽéń╗ŐŔÁ░ňůąŠëőŠť║ŃÇüŠëőŔíĘ´╝îŠĺĹŔÁĚńŞëňŹâń║┐šżÄňůâňŞéňť║ŃÇé
ńŞÜňćůńŞôň«ÂÚóäŠÁő´╝îňŹĽš╗ćŔâ׊Áőň║ĆŠť¬ŠŁąń║öňł░ňŹüň╣┤ň░ćŔ┐ÄŠŁąŠłÉŠťČšÜäŠ×üÚÇčńŞőÚÖŹ´╝îŔÁ░Ŕ┐ŤÔÇťň╣│Š░ĹšÄęň«ÂÔÇŁň«×Ú¬îň«Ą´╝ÉńŞ║šö蚞ŚáöšęÂŃÇüŔŹ»šëęšáöňĆĹŃÇüńŞ┤ň║Őň║öšöĘšÜäňŞŞŔžäÚüôňůĚŃÇéňŹĽš╗ćŔâ׊Áőň║Ć´╝»ÔÇťň╣│Š░ĹšÄęň«ÂÔÇŁšÜ䊝¬ŠŁąŠşŽňÖĘŃÇé
šá┤ňŁĆŠŞŞŠłĆň╣│ŔííšÜäÚüôňůĚ´╝îÚ⯊ťëÔÇťš¬âňĄęń╣őŔâŻÔÇŁ´╝ÜNGSŔâŻňĄčŔ»╗ňĆľšöčňĹŻšÜäň║Ľň▒éń╗úšáü´╝îAIŔâŻňĄčŠĘíŠőčń║║ŔäĹňÄ╗ŠÇŁŔÇâŃÇéŠÉşň╗║šöčňĹŻšÜäňč║ŠťČŠĘíňŁŚŠś»š╗ćŔâ×´╝îňŹĽš╗ćŔâ׊Áőň║ĆňüÜňł░šÜ䊜»ŠŐŐŠ»ĆńެŠĘíňŁŚÚ⯊őćŔžúňç║ŠŁą´╝îŠîĘńެŔ»╗ňĆľš╝ľšáü´╝îšöÜŔç│ňĆ»ń╗ąš╗ôňÉłń╗úšáüšÜäňŐčŔ⯴╝îńŻŹšŻ«ŃÇéŔ┐ÖŠáĚ´╝áŔ«║Šś»ň«ÜňÉĹšá┤ŔžúŔ┐śŠś»ŠŞŞŠłĆš╗┤ŠŐĄ´╝îÚâŻň░ćňĆśňżŚŠ×üńŞ║š«ÇňŹĽŃÇé
ń╝áš╗čšÜäŠÁőň║Ćšáöšę´╝îŔÄĚňĆľšÜ䊜»š╗ćŔâךżĄńŻôšÜäŠÇ╗ńŻôň╣│ňŁçšë╣ňżüŃÇéńŻćňŽéŠ×ťňŹĽńެš╗ćŔâ׊Łą´╝Ĺń╗ČňĆ»ń╗ąňżłň«╣Šśôňť░ň░ćń╗ľń╗Čš╗ćňłćńŞ║ńŞŹňÉîšÜäš▒╗ňłźŃÇéňŹ│ńŻ┐ňÉîńŞÇš▒╗ň×őšÜäš╗ćŔâ×ń╣őÚŚ┤ń╣čňşśňťĘň╝éŔ┤ĘŠÇžŃÇ銻öňŽéňťĘŔé┐šśĄš╗äš╗çńŞş´╝îňÉäš╗ćŔâךÜäňč║ňŤáš╗äňĺîŔŻČňŻĽš╗äšşëÚüŚń╝áń┐íŠü»ňşśňťĘňĚ«ň╝é´╝îŔ┐ÖňĆ»ń╗ąňć│ň«ÜšľŚŠ│ĽšÜ䊝늼łŠÇžŃÇé
ňťĘš╗ćŔâךżĄńŻôšÜäŠÁőň║ĆńŞş´╝░ÚçĆšĘÇň░ĹšÜäš╗ćŔâ×ŔĽ┤ňÉźšÜäńŻÄńŞ░ň║Žšë╣ňżüňżÇňżÇŔ󟊼░ÚçĆŠŤ┤ňĄÜšÜäšżĄńŻôšë╣ňżüŠÄꚍľ´╝îńŞóňĄ▒šë╣ŠťëšÜäń┐íŠü»ŃÇéň╣ÂńŞöš╗ćŔâךÜäÚüŚń╝áŃÇüŔíĘŔżżń┐íŠü»ńŞÄŔíîńŞ║ń╣芌áŠ│ĽŔüöš│╗ŔÁĚŠŁą´╝îŔ┐ŤŔí┤ŠĚ▒ňůąšÜäňłćŠ×ÉŃÇé
š┐╗Ŕ»ĹńŞÇńŞő´╝ÜŠ»ĆńŞÇńެš╗ćŔâ×´╝îÚ⯊ś»šőČńŞÇŠŚáń║îšÜäŃÇéń╗ąň돊łĹń╗ČňüÜňč║ňŤáš╗äňĺîŔŻČňŻĽš╗äŠÁőň║Ć´╝îň░▒ňąŻŠ»öš╗ćŔâךÜäňĄžňÉłňö▒´╝îňƬŔ⯚ťőň╣│ňŁçŠ░┤ň╣│ŃÇ銝ëń║ćňŹĽš╗ćŔâ׊Áőň║Ćň░▒ńŞŹńŞÇŠáĚń║ć´╝îňĄžň«ÂŠîĘńެšőČňö▒´╝îŔ░üŠ╗ąšźŻňůůŠĽ░Ŕ░üňťĘŠÉ×ń╣▒ńŞÇńŞőňşÉň░▒Ŕ⯚ťőňç║ŠŁąŃÇé

ňŤż1 ňŹĽš╗ćŔâ׊Áőň║ĆňżŚňł░Š»Ćńެš╗ćŔâךÜäń┐íŠü»´╝îň»╣šöčňĹŻŔ«ĄščąŠŤ┤ńŞ║ňçćší«
ňč║ń║Ä10x GenomicsňĆĹŔíĘšÜ䊾皟áŠÇ╗ŠĽ░ňĚ▓š╗Ćš¬üšá┤23,000š»ç´╝Ćň╣┤šÜ䊾皟ኼ░ÚçĆń╗ą2.4ňÇŹšÜäÚÇčň║Žňó×ÚĽ┐ŃÇ隍«ň돚ÜäšáöšęÂňŹĽš╗ćŔâ׊Áőň║ĆšáöšęÂŔŽćšŤľŔé┐šśĄŃÇüňůŹšľźŃÇüšą×š╗ĆŃÇüŔżůňŐęšö芫ľňŤŤňĄžŠľ╣ÚŁó´╝îšöĘń║ÄšÉćŔžúňŹĽš╗ćŔâ׊░┤ň╣│ńŞŐšÜäšöčšÉćňĺůšÉ抝║ňłÂ´╝îŠëżňł░Šľ░šÜäŔ»ŐŠľşŠáçŔ«░ŠłľŠ▓╗šľŚÚŁÂŠáç´╝îńŞ║Šö╣ňľäšľżšŚůšÜäŔ»ŐŠľşňĺîŠ▓╗šľŚŠĆÉńżŤň«×ŔĚÁńżŁŠŹ«ŃÇé
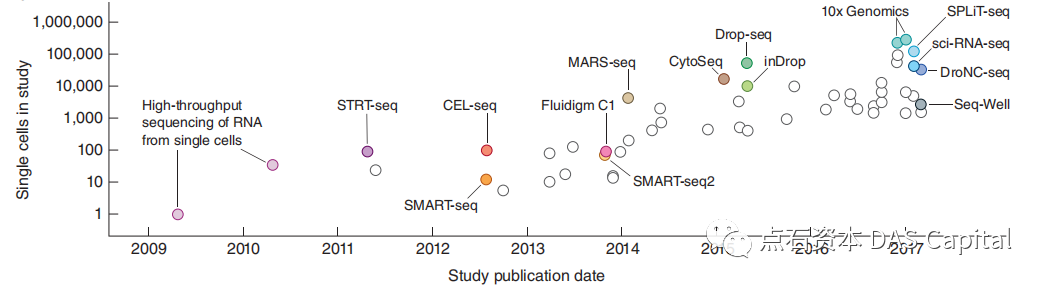
ňŤż2 ňŹĽš╗ćŔâ׊Áőň║ĆšáöšęÂŔžüňłŐŠĽ░ÚçĆšłćňĆĹ
ňťĘ2018ň╣┤ScienceňůČňŞâšÜäňŹüňĄžšžĹňşŽš¬üšá┤ńŞş´╝îňŹĽš╗ćŔâ׊Áőň║ĆńŻŹňłŚňŹüňĄžš¬üšá┤ń╣őÚŽľŃÇé2019ň╣┤´╝îňŹĽš╗ćŔâ×ňĄÜš╗äňşŽŠŐÇŠť»ŔóźNature MethodsŔ»äńŞ║ň╣┤ň║ŽŠŐÇŠť»ŃÇéňł░ń║ć2020ň╣┤´╝îńŞÄňŹĽš╗ćŔâ×ŔŻČňŻĽš╗äŠÁőň║ĆšŤŞŔżůšŤŞŠłÉšÜäšę║ÚŚ┤ŔŻČňŻĽš╗äŠŐÇŠť»ŔŹúšÖ╗Nature Methodsň╣┤ň║ŽŠŐÇŠť»ŃÇé

ňŤż3 ňŹĽš╗ćŔâ׊Áőň║ĆŠś»Ŕ┐ĹňŹüň╣┤ŠťÇňĆŚš×ꚍ«šÜäŠŐÇŠť»š¬üšá┤
Ŕ笊Áőň║ĆňĚąňůĚŔ»×šöčŔÁĚ´╝îňŹĽš╗ćŔâךÜäŠÁőň║Ćň░▒ńŞŹŠś»ńެÚÜżŠâ│ňł░šÜäšé╣ňşÉ´╝îÚÜżšé╣ňťĘń║ÄÚźśÚÇÜÚçĆńŻÄŠłÉŠťČňłćšŽ╗š╗ćŔâ×ŃÇ銝NJŚęšÜ䊾╣Š│ĽŠś»ŠëőňĚąňłćšŽ╗ňŹĽš╗ćŔâ×´╝öňŽéňťĘŠśżňż«ÚĽťńŞő´╝îšöĘŠ»Ťš╗ćš«íń╗ÄňÉäš▒╗ŠáĚňôüńŞşňÉŞňĆľňŹĽńެš╗ćŔâ×ŃÇéňůÂń╗ľňŽéŠ┐Çňů늏ĽŔÄĚŠśżňż«ňłćšŽ╗ŃÇüŠťëÚÖÉšĘÇÚçŐŠ│Ľ´╝ČŔ║źňłćšŽ╗ňçćší«ŠÇžńŞŹÚźś´╝ƊČíňĄäšÉćšÜäš╗ćŔâ׊Ľ░ÚçĆň░Ĺ´╝ÂÚŚ┤ŃÇüń║║ňŐŤŠłÉŠťČŠ×üÚźśŃÇéň╣ÂńŞö´╝îňłćšŽ╗ňç║ŠŁąšÜäš╗ćŔâ×ňŽéŠ×ťňłćňłźň╗║ň║ôŠÁőň║Ć´╝îÚÜĆšŁÇňżůŠÁőš╗ćŔâ׊Ľ░ňó×ÚĽ┐´╝îŠÁőň║ĆšÜ䊳ɊťČń╣čňçáń╣ÄňĹłš║┐ŠÇžŠĆÉňŹç´╝îÚÜżń╗ąŠö»ŠĺĹÚźśÚÇÜÚçĆšáöšęÂŃÇé
ňż«ŠÁüŠÄžňĆ»ń╗ąňťĘňż«š▒│š║žš╗ôŠ×äńŞşŠôŹŠÄžňż«ň░ĆŠÂ▓ńŻô´╝îńŞÄňŹĽš╗ćŔâ׊Áőň║ĆŠś»ňĄęńŻťń╣őňÉłŃÇéÚÇÜŔ┐çňż«ŠÁüŠÄžŠŐÇŠť»ň░ćš╗ćŔâ×ŔżôňůąŠ▓╣šŤŞňşöÚüô´╝îňŻóŠłÉÔÇťŠ▓╣ňîůŠ░┤ÔÇŁšÜäŠÂ▓Š╗┤´╝îňĆ»ń╗ąňťĘńŞÇňŁŚňż«š▒│ň░║ň║ŽšÜäŔŐ»šëçńŞŐŔç¬ňŐĘň«îŠłÉňłćšŽ╗ŃÇéFluidigmňůČňĆŞšÄçňůłň░ćňč║ń║Äňż«ŠÁüŠÄžšÜäňŹĽš╗ćŔâ׊Áőň║ĆňĽćńŞÜňîľ´╝îŔâŻňĄčňťĘňçáň░ĆŠŚÂňćůŠŹĽŔÄĚ96ńެš╗ćŔâ×´╝îńŻćň╣Šť¬Ŕžúňć│ńŞŐŔ┐░ÚÇÜÚçĆńŞÄŠłÉŠťČÚŚ«ÚóśŃÇé
ÚŁęňĹŻŠÇžšÜäŠö╣ňĆśŠŁąŔç¬ń║ÄňôłńŻŤňĄžňşŽŠĽÖŠÄłDavid WeitzšşëňĆĹŔíĘšÜäDrop-SeqŠŐÇŠť»ŃÇéŔ┐Öš»ç2015ň╣┤ňłŐń║ÄCellšÜäšáöšę´╝îÚççšöĘń║ćňż«Š╗┤ňîůŔú╣ňŹĽš╗ćŔâךÜ䊾╣Šíł´╝îň╣Âň╝Ľňůąń║ćŠáçšşż´╝łbarcode´╝ëŃÇéÚÇÜŔ┐çš╗ÖŠ»Ćńެš╗ćŔâ׊ëôńŞŐšőČšë╣šÜäDNAň║ĆňłŚŠáçšşż´╝îňÉîńŞÇŠáçšşżšÜäń┐íŠü»ň░▒ŠŁąŔç¬ňÉîńŞÇńެš╗ćŔâ×ŃÇéŔ┐ÖŠáĚ´╝îň░▒ňĆ»ń╗ąňƬڝÇŔŽüňüÜńŞÇŠČíŠÁőň║Ć´╝îň░▒Ŕ⯚čąÚüôŠ»Ćńެš╗ćŔâךÜäń┐íŠü»ŃÇéňłęšöĘDrop-seqŠŐÇŠť»´╝îšžĹňşŽň«ÂňĆ»ń╗ąňťĘ12ň░ĆŠŚÂňćůňçćňĄç10,000ńެňŹĽš╗ćŔâ׊ľçň║ôŔ┐ŤŔíîŠÁőň║Ć´╝Ćńެš╗ćŔâךÜ䊳ɊťČš║ŽńŞ║6.5šżÄňłćŃÇé
ňŤż4 ňŹĽš╗ćŔâ׊Áőň║ĆÚÇÜÚçĆňĆśňîľ
ňŹĽš╗ćŔâ׊Áőň║ĆšÜäÚżÖňĄ┤ń╝üńŞÜ10x GenomicsŠŐÇŠť»ŔÁĚŠ║ÉŔç¬Drop-SeqŃÇéňÉźŠťëŠáçšşżń┐íŠü»šÜäňçŁŔâšĆá´╝îňťĘšČČńŞÇńެňŹüňşŚŔĚ»ňĆúÚüçňł░ŠáĚŠťČš╗ćŔâ×ň╣š╗ôňÉłŃÇéňťĘšČČń║îńެňŹüňşŚŔĚ»ňĆú´╝îŠ▓╣Š╗┤ň░ćš╗ćŔâ×ňĺîňçŁŔâšĆáňîůŔú╣ŔÁĚŠŁą´╝îňŻóŠłÉńŞÇŠ╗┤Š╗┤šÜäÔÇťŠ▓╣ňîůŠ░┤ÔÇŁŠÂ▓Š╗┤ŃÇéňŹĽńެšÜäš╗ćŔâ×ňŹ│Ŕ󟊏ĽŔÄĚ´╝îÚÜĆšŁÇňÉÄš╗şš╗ćŔâ×ŔúéŔžú´╝îňçŁŔâšĆáŔç¬ňŐĘŠ║ÂŔžúÚçŐŠöżňĄžÚçĆŠáçšşż´╝îŔ┐Öń║ŤŠáçšşżńŞÄmRNAšŤŞš╗ôňÉł´╝Ćńެš╗ćŔâךÜäÚüŚń╝áń┐íŠü»ÚâŻŔóźŠáçŔ«░ŔÁĚŠŁą´╝îňĆ»ń╗ąšöĘń║ÄňÉÄš╗şŠÁőň║ĆŃÇé
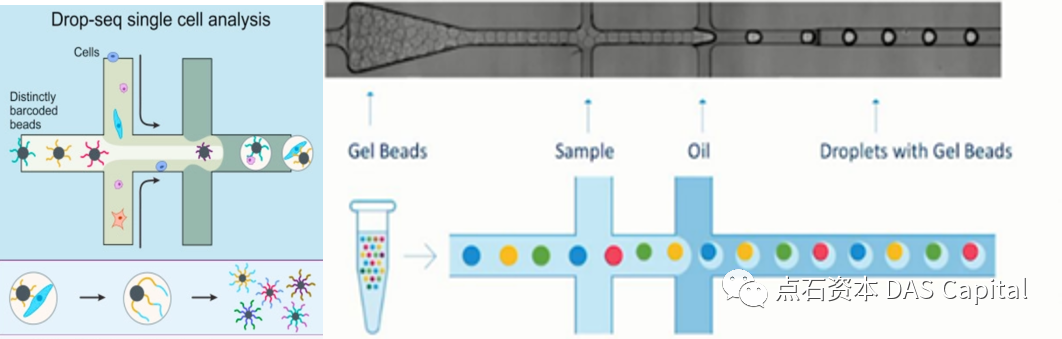
ňŤż5 10x GenomicsŠŐÇŠť»ŔÁĚŠ║ÉŔç¬Drop-Seq
Ŕç¬ňŐĘňîľÚźśÚÇÜÚçĆŔ«żňĄçšÜäŔ»×šöčŠ×üňĄžňť░ÚÖŹńŻÄń║ćňŹĽš╗ćŔâ׊Áőň║ĆšÜäń║║ňŐŤŃÇüŠŚÂÚŚ┤ŃÇüŔ»Ľňë銳ɊťČ´╝îňŞŽŠŁąń║ćŔ┐Ĺń║öň╣┤ŔÁŤÚüôšÜäń║ĽňľĚň╝ĆňĆĹň▒ĽŃÇé10x GenomicsÚóćŔĚĹňŹĽš╗ćŔâ׊Áőň║ĆŔÁŤÚüô´╝îň╣ÂńŻŹň▒ůŔ┐ĹňŹüň╣┤šżÄŔéíńŞŐňŞéšÜäňłŤŠľ░šöčšžĹňĚąňůĚňůČňĆŞŠŽťÚŽľŃÇéňůÂňŞéňÇ╝´╝ł2022ň╣┤7Šťł3ŠŚą´╝늜»šČČń║îňÉŹOlinkšÜä2.8ňÇŹŃÇé
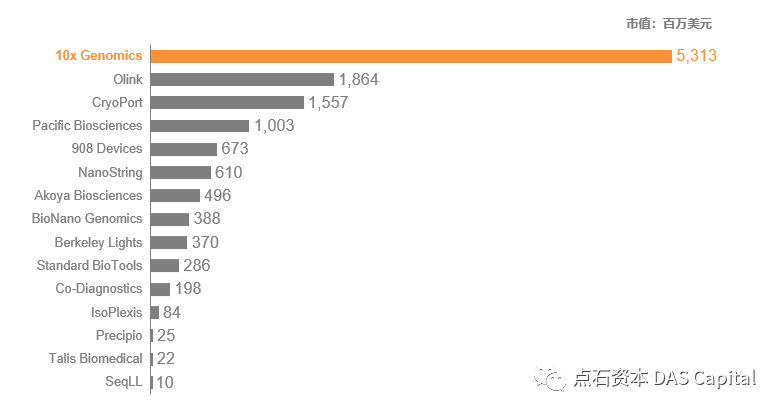
ňŤż6 Ŕ┐ĹňŹüň╣┤šżÄŔéíńŞŐňŞéšÜäŔ»ŐŠľş&šöčšžĹňĚąňůĚňŞéňÇ╝´╝łšÖżńŞçšżÄňůâ´╝ë
ÚÖĄń║ćŠÁőň║ĆŠłÉŠťČŔÂůŠĹęň░öň«ÜňżőÚÖŹńŻÄ´╝îÚÜĆšŁÇň╗║ň║ôŠŐÇŠť»ń╝śňîľŃÇüńżŤň║öÚôżňŤŻń║žňîľŃÇüŔ«żňĄçŔç¬ňŐĘňîľšĘőň║ŽŠĆÉÚźś´╝îňŹĽš╗ćŔâ׊Áőň║ĆŠłÉŠťČń╣čň░ćŔ┐ŤńŞÇŠşąńŞőÚÖŹŃÇé
ňŤż7 ňŹĽš╗ćŔâ׊Áőň║ĆŠłÉŠťČńŞőÚÖŹšę║ÚŚ┤ňĚĘňĄž
´╝ł1´╝ëň╗║ň║ôŠŐÇŠť»ń╝śňîľ´╝Üń╝ŚňĄÜšáöšęÂŔç┤ňŐŤń║ÄŠĆÉňŹçňŹĽš╗ćŔâ×ňłÂňĄçšÜäÚÇÜÚçĆŃÇéÚÜĆšŁÇŠÂ▓Š╗┤šö芳ɊŐÇŠť»ń╝śňîľŃÇüŠŹĽŔÄĚŠĽłšÄçŠĆÉňŹç´╝îšö芳ÉňÉ늼░ÚçĆš╗ćŔâךÜäÚÇčň║ŽŠŤ┤ň┐źŃÇüŔ»ĽňëéšöĘÚçĆŠŤ┤ň░ĹŃÇéŠĚĚŠáĚŠÁőň║ĆŠś»ňĆŽńŞÇÚí╣Ú╗ĹšžĹŠŐÇŃÇéňťĘš╗Öš╗ćŔâ׊ëôŠáçšşżšÜäšĘőň║ŽńŞŐŠŤ┤Ŕ┐ŤńŞÇŠşą´╝îš╗ÖŠáĚŠťČń╣čŠëôńŞŐńŞŹňÉîšÜäŠáçšşż´╝îňĆ»ń╗ąň░ćňĄÜńެŠáĚŠťČŠĚĚňťĘńŞÇŔÁĚň╗║ň║ô´╝îňçĆň░ĹŠÁőň║ĆŠČ튼░ŃÇéŔ┐ÖÚí╣Ú╗ĹšžĹŠŐÇÚťÇŔŽüń║žšöčšÜäňŹĽš╗ćŔâ׊Ľ░ÚçĆŠłÉňÇŹňó×ÚĽ┐´╝îňÉîŠáĚńżŁŔÁľň╗║ň║ôÚÇÜÚçĆšÜäŠĆÉÚźśŃÇé
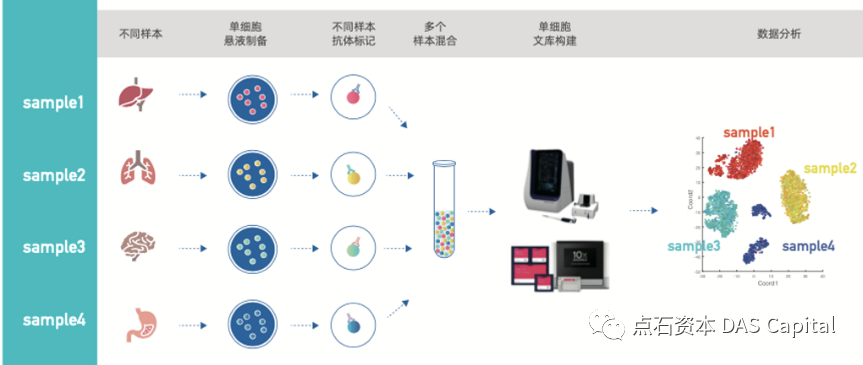
ňŤż8 ňŹĽš╗ćŔâ׊ĚĚŠáĚŠÁőň║ĆšĄ║ŠäĆňŤż
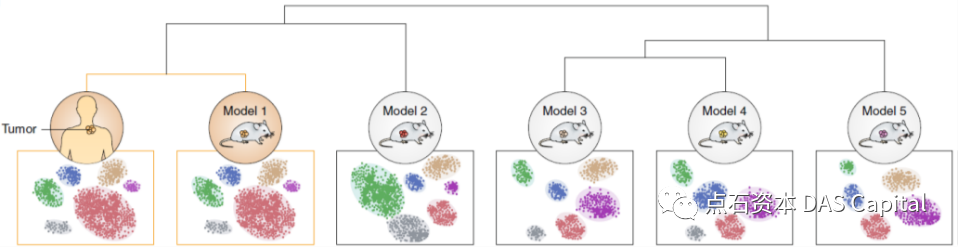
´╝ł2´╝ëńżŤň║öÚôżňŤŻń║žňîľ´╝Üšö▒ń║ÄŠÄîŠĆíň«Üń╗ĚŠŁâ´╝îň╣ÂńŞöšöčń║žňč║ňť░ńŞŹňťĘńŞşňŤŻ´╝î10xŔ«żňĄçŔ┐Ťňůąš╗łšź»ŔÂůšÖżńŞçňůâ/ňąŚ´╝îň╗║ň║ôŔ»Ľňë隍ĺŔ┤╣šöĘŔÂůńŞçňůâ/ŠáĚŠťČŃÇéňŤŻń║žňŹĽš╗ćŔâ׊Áőň║ĆňĚąňůĚń╝üńŞÜšÜäň┤ŤŔÁĚ´╝îň░ćňć▓ňç╗10xšÜäń╗ĚŠá╝ńŻôš│╗ŃÇ隍Şňů│ńżŤň║öÚôż´╝łŔ«żňĄçŃÇüŔ»ĽňëéŃÇüňż«ŠÁüŠÄžŔŐ»šëçŃÇüšöčń┐íňłćŠ×É´╝ëňŤŻń║žňîľšĘőň║ŽÚźśšÜäňůČňĆŞ´╝îň░ćňůĚňĄçŠŤ┤ňĄžšÜäšź×ń║ëń╝śňŐ┐ŃÇé
´╝ł3´╝ëŔç¬ňŐĘňîľÚÖŹńŻÄń║║ňĚąŠłÉŠťČ´╝ÜňŹĽš╗ćŔâ×ň╗║ň║ôš│╗š╗čň╣Š▓튝ëŔžúňć│ŠáĚŠťČňëŹňĄäšÉćń╗ąňĆŐŔ«żňĄçÚŚ┤ŠáĚŠťČŔŻČšž╗šÜäÚŚ«Úóś´╝«ňëŹńŞ╗ŔŽüńżŁŔÁľń║║ňŐŤŃÇéŔÇŚŠŚÂŔÇŚňŐŤń╣őńŻÖ´╝îńŞÇňĆ░Ŕ«żňĄçŠ»Ćň╣┤ňƬŔâŻňĄäšÉć100ňĄÜńެŠáĚŠťČŃÇ銝¬ŠŁąňůĘŠÁüšĘőšÜäŔç¬ňŐĘňîľň░ćňŞŽŠŁąŠŤ┤š«Çńż┐ŃÇüÚźśŠĽłšÜ䊾╣ŠíłŃÇé
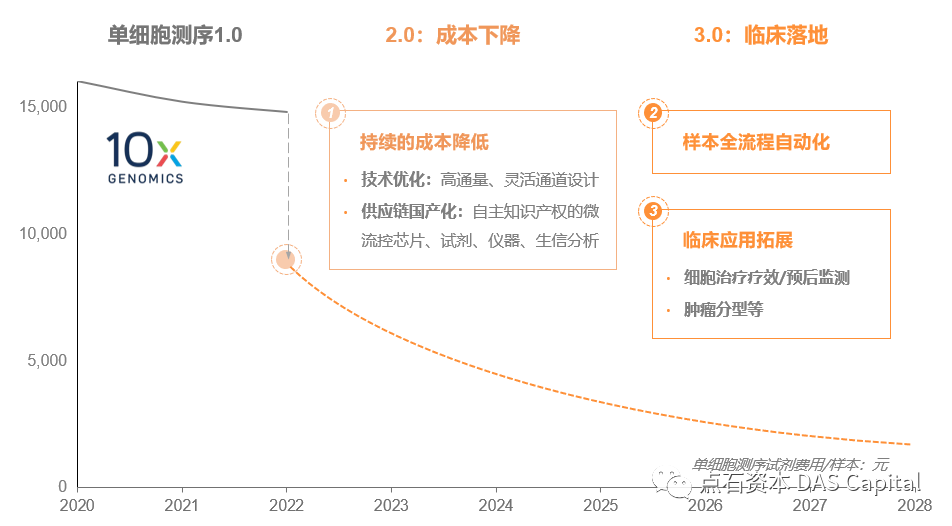
ŠëÇŔ░ôÔÇťň╣│Š░ĹšÄęň«ÂÔÇŁšÜäŔâîňÉÄ´╝»ňĄžŔžäŠĘíŃÇüňĄÜňť║ŠÖ»ň║öšöĘšÜäň╣┐ÚśöňŞéňť║ŃÇéňĆéŔÇâń║║ňĚąŠÖ║Ŕ⯚Üäň║öšöĘ´╝îń╝┤ÚÜĆŠłÉŠťČńŞőÚÖŹ´╝îňůĘšÉâń║║ňĚąňŞéňť║ń╗Ä2016ň╣┤šÜä600ń║┐ŠÜ┤ŠÂĘŔç│Ŕ┐Ĺ3,000ń║┐šżÄňůâŃÇéňŹĽš╗ćŔâ׊Áőň║ĆŠť¬ŠŁąń╣čň░ćŔÁ░ňůąŠ»ĆńŞÇńެňłćňşÉŠúÇŠÁőň«×Ú¬îň«Ą´╝ÉńŞ║š▓żňçćňî╗šľŚšÜäň┐ůňĄçňĚąňůĚŃÇé
ŠÜ┤ŠÂĘšÜ䊾皟ኼ░ňŹ░Ŕ»üń║ćňŹĽš╗ćŔâ׊Áőň║ĆňťĘšžĹšáöÚóćňččšÜäň┐źÚÇ芪ŚÚÇĆŃÇéňťĘŔŹ»šëęšáöňĆĹÚóćňčč´╝îňŹĽš╗ćŔâ׊Áőň║Ćń╣čňĚ▓š╗ĆňťĘňĆĹŠîąńŞżÚçŹŔŻ╗Ú珚ÜäńŻťšöĘŃÇéň»╣ń║ÄŠľ░ŔŹ»šáöňĆĹńŞşŠÂëňĆŐšÜäńŞÇń║Ťňů│Úö«ÚŚ«Úóś´╝îňŹĽš╗ćŔâ׊Áőň║ĆŠŐÇŠť»ÚâŻńŻôšÄ░ňç║šőČšë╣šÜäń╝śňŐ┐´╝îňîůŠőČ´╝ÜŠľ░ŔŹ»ÚŁÂšé╣šÜäňĆĹšÄ░ňĆŐÚ¬îŔ»üŃÇüší«ň«ÜŠľ░šÜäňłćňşÉŠáçň┐ŚšëęŃÇüŠľ░ŔŹ»ÚÇéšöĘšżĄšÜäš▓żší«ŠčąŠëżŃÇüŠŤ┤ňąŻšÜäŔüöňÉłšöĘŔŹ»Šľ╣ŠíłšÜäší«ň«ÜŃÇé
ń╗ąŠľ░ŔŹ»ÚŁÂšé╣ňĆĹšÄ░ńŞ║ńżő´╝îš╗ĆňůŞšÜ䊯ťňťĘŔŹ»šëęڣšé╣ňĄÜňťĘŠ┐ÇÚůÂŃÇüGPCRšşëňłćňşÉńŞŐŃÇéÚÇÜŔ┐çňŹĽš╗ćŔâ׊Áőň║Ć´╝Ĺń╗ČňĆ»ń╗ąŠúÇŠÁőŔ┐Öń║ŤŠŻťňťĘŔŹ»ÚŁÂňłćňşÉňťĘńŞŹňÉîš╗ćŔâךżĄńŻôÔÇöÔÇöňŽéT cellŃÇüDCsŃÇüŠłÉš║Ąš╗┤š╗ćŔâךşëšżĄńŻôńŞŐŔíĘŔżżšÜäšë╣ňżüŃÇéń╗ÄňŹĽš╗ćŔâ׊░┤ň╣│ńŞŐÚ珊ľ░Ŕ»äń╝░š╗ĆňůŞŔŹ»šëęڣšé╣šÜäŔíĘŔżż´╝îňč║ń║ÄňŹĽš╗ćŔâךë╣ň╝éŠÇžŔ┐ŤŔíîšÉćŠÇžňť░ÚÇëŠőęŔŹ»ÚŁÂňłćňşÉ´╝îŔâŻňĄčŠĆÉÚźśŔŹ»šëęšáöňĆĹšÜ䊼łšÄçňĺÉňŐčšÄçŃÇé
Š»öňŽéňťĘŔé┐šśĄÚóćňčč´╝îÚÇÜŔ┐çňŹĽš╗ćŔâ׊Áőň║ĆňĆ»ń╗ąŔ»äń╝░Ŕé┐šśĄšÜ䊼┤ńŻôň╝éŔ┤ĘŠÇžňĺîš╗䊳Éń╗ąňĆŐšë╣ň«ÜšÜäšë╣ňżü´╝łňŽéŠ»ĆšžŹš╗ćŔâך▒╗ň×őšÜäňůŹšľźŠ▓╗šľŚÚŁÂšé╣ŔíĘŔżż´╝ëŃÇéňč║ń║ÄŠşĄ´╝îňĆ»ń╗ąŠŤ┤šÉćŠÇžŃÇüŠŤ┤ňçćší«ňť░ÚÇëŠőęŔŹ»šëęڣšé╣´╝îŠĆÉńżŤŔŹ»ÚŁÂŠłÉňŐčšÄçŃÇé
ňŤż9 ňŹĽš╗ćŔâ×ňŐęňŐŤŔŹ»šëęڣšé╣ňĆĹšÄ░
ňťĘńŞ┤ň║Őšź»´╝îňŹĽš╗ćŔâ׊Áőň║ĆňťĘňŹĽńެš╗ćŔâ׊░┤ň╣│ńŞŐŔžúŠ×Éń║║šÜäÚüŚń╝áŔâîŠÖ»´╝îńŞ║š▓żňçćšöĘŔŹ»ňąáň«Üń║ćń┐íŠü»ňč║šíÇŃÇéňŹĽš╗ćŔâ׊Áőň║ĆŠŐÇŠť»ń╣čńŞ║ń╝┤ÚÜĆŔ»ŐŠľşňĺîÚóäňÉÄÚóäŠÁőŠĆÉńżŤń║抯ťňťĘšÜäňłćŠ×ÉŠáçň┐Śšëę´╝îńŻ┐ňżŚšöĘŔŹ»šÜ䚍«šÜäŠÇžŠŤ┤ň╝║´╝┤ŠťëŠĽł´╝îňÉÂń╣čÚÖŹńŻÄń║ćŠ▓╗šľŚŠłÉŠťČŃÇé
2022ň╣┤´╝îňůĘšÉâšČČńŞÇšÜäšÖçšáöšęŠëÇMD Anderson Cancer CenterňŤ×Úíżń║ćŔé┐šśĄšÜäňŹĽš╗ćŔâ×ňĄÜš╗äňşŽšáöšę´╝îŠĆÉňç║ń║ćŔé┐šśĄš▓żňçćňî╗šľŚšÜäÔÇťš╗äňÉłŠő│ÔÇŁ´╝ÜňťĘŔŻČňŻĽš╗äŠ░┤ň╣│ńŞŐ´╝îňŹĽš╗ćŔâ׊Áőň║ĆňĚ▓ŔóźšöĘń║Äń║ćŔžúňůŹšľźŠüŠǞš╗ćŔâךŻĹš╗ť´╝îń╗ąňĆŐŔé┐šśĄńżÁŔ󺊝║ňłÂ´╝ŤňťĘňč║ňŤáš╗äňĺîŔíĘŔžéš╗äŠ░┤ň╣│´╝îňĚ▓ňłćňłźšöĘń║ÄšáöšęÂŔé┐šśĄŔ┐ŤňłľŔŻČšž╗ńŞşňşśňťĘšÜäňč║ňŤáš¬üňĆśŃÇéňťĘŔŤőšÖŻŔ┤Ęš╗äŠ░┤ň╣│ńŞŐ´╝îňŹĽš╗ćŔâ׊Áőň║ĆňĚ▓ŔóźšöĘń║ÄŔ»ćňłźšöčšëęŠáçň┐Śšëę´╝îšöĘń║ÄšöĘŔŹ»Šîçň»╝ŠłľÚóäňÉÄŔ»äń╝░ŃÇéň╣ÂńŞö´╝îňŹĽš╗ćŔâ׊Áőň║Ćš┤»šž»ń║ćňĄžÚçĆš╗╝ňÉłŠĽ░ŠŹ«ň║ôňĺîňť░ňŤżÚŤć´╝îňĆ»ň║öšöĘń║ÄňÉäšžŹšŤŞňů│šáöšęÂŃÇé
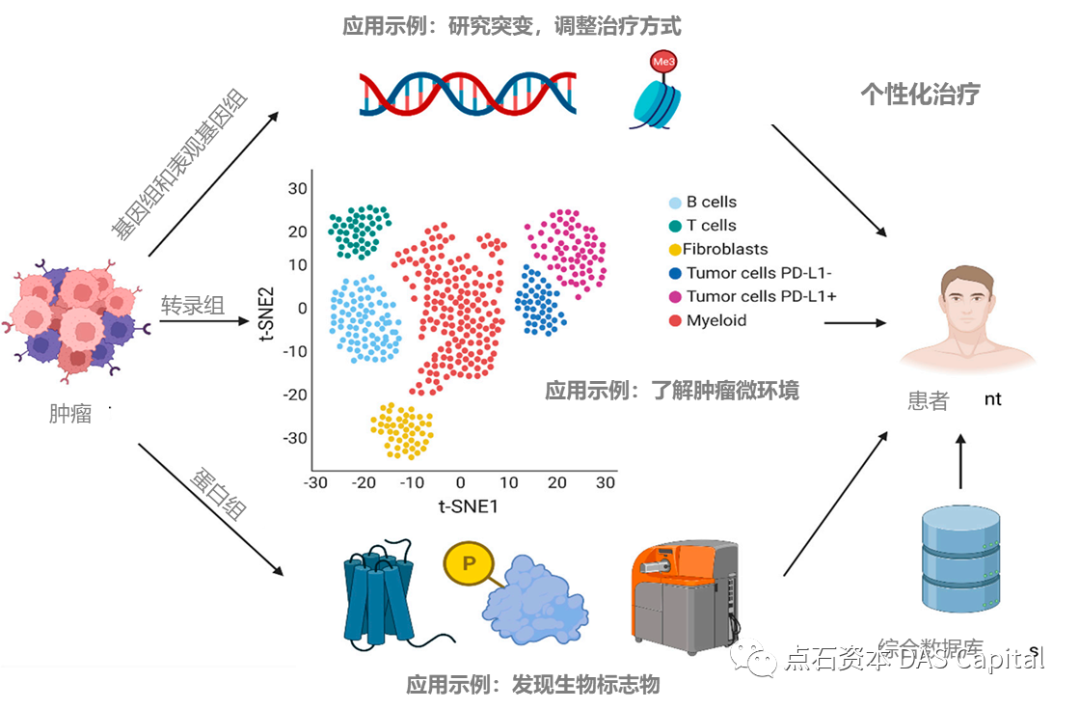
ňŤż10 ňŹĽš╗ćŔâ׊Áőň║ĆŠŐÇŠť»ňťĘŔé┐šśĄš▓żňçćňî╗šľŚšÜäň║öšöĘ
ňŹĽš╗ćŔâ×ňĚ▓š╗ĆńŞŹň▒ÇÚÖÉňťĘňô║ń╣│ňŐĘšëęš╗ćŔâ׊Áőň║Ć´╝îŔ┐ĹŠťčÚŽľŠČíň║öšöĘňĽćńŞÜňîľňż«šöčšëęňŹĽš╗ćŔâ׊Áőň║ĆšÜ䊾皟áňĆĹŔíĘń║ÄŃÇŐScienceŃÇőŃÇéňż«šöčšëęňŹĽš╗ćŔâ׊ŐÇŠť»ÚźśŠĽłň┐źÚÇčňť░ŔžúŠ×ÉňŹĽńެŔĆîŠá¬šÜäÚüŚń╝áń┐íŠü»ňĆŐŔíĘŔżż´╝îňĆ»ń╗ąŠŤ┤ň«╣Šśôňť░ňĆĹšÄ░Šťëń╗ĚňÇ╝šÜäŔĆîŠá¬´╝îšÉćŔžúňż«šöčšëęÚüŚń╝áń┐íŠü»ńŞÄňŐčŔ⯚Üäňů│š│╗ŃÇéň║öšöĘňť║ŠÖ»šÜäŔ┐ŤńŞÇŠşąŠőôň▒Ľ´╝늝ŤÚçŹňíĹńŞőŠŞŞňż«šöčŠÇüŔŹ»šëęňĆĹšÄ░ňĆŐňÉłŠłÉšöčšëęňşŽŃÇé

ňŤż11 ňż«šöčšëęÚźśÚÇÜÚçĆňŹĽš╗ćŔâ×ňč║ňŤáš╗äňşŽŠŐÇŠť»š¬üšá┤
šťčŠáŞňŹĽš╗ćŔâ׊ŐÇŠť»ň║öšöĘń║Äňż«šöčšëęÚí╗ňůőŠťŹňçáňĄžÚÜťšóŹŃÇéÚŽľňůł´╝îš╗ćŔĆîmRNAńŞŹňîůňÉźšťčŠáŞmRNAńŞşňşśňťĘšÜä3′ poly-Aň░ż´╝îŔÇÇňŞŞŔžüšÜäšťčŠáŞŠŐÇŠť»ńŻ┐šöĘpoly-Aň░żńŻťńŞ║ńŞÇńެšë╣ňżü´╝îŔ┐ÖŠäĆňĹ│šŁÇň┐ůÚí╗ň╝ÇňĆĹńŞÇšžŹň»îÚŤćmRNAšÜ䊾░Šľ╣Š│ĽŃÇéšČČń║î´╝îńŞÄňô║ń╣│ňŐĘšëęmRNAÚĽ┐Ŕżżň░ĆŠŚÂšÜäňŹŐŔí░ŠťčšŤŞŠ»ö´╝îš╗ćŔĆîmRNAšÜäňŹŐŔí░Šťčń╗ąňłćÚĺčŔ«í´╝îň╣ÂńŞöńŞ░ň║ŽňĄžš║ŽńŻÄ100ňÇŹŃÇéŔžúňć│Ŕ┐ÖńŞÇÚŚ«ÚóśÚťÇŔŽüšĘ│ň«ÜŔ┐Öń║Ťščşň»┐ňĹŻňĺîšĘÇšľĆšÜämRNA´╝îň╣ÂńŞöń╗ąŔÂ│ňĄčÚźśšÜäÚÇčšÄ犏ĽŔÄĚŃÇ銝ÇňÉÄ´╝îňż«šöčšëęš╗ćŔâ×ňúüňĄÜšžŹňĄÜŠáĚńŞöÚÜżń╗ąŔúéŔžú´╝îÚťÇŔŽüň╝ÇňĆĹŠľ░šÜäŔúéŔžúŠŐÇŠť»ŃÇé
´╝ł1´╝ëňŹĽš╗ćŔâ׊Áőň║ĆňŐęňŐŤňż«šöčŠÇüŔŹ»šëęňÇÖÚÇëŔĆîŠá¬ŠîľŠÄś´╝Üňż«šöčŠÇüŔóźšž░ńŞ║ÔÇťń║║ńŻôšČČń║îňč║ňŤáš╗äÔÇŁ´╝îńŞÄŔéáÚüôšľżšŚůŃÇüŔéąŔâľŃÇüš│ľň░┐šŚůŃÇüŔé┐šśĄšşëňĆĹšöčň»ćňłçšŤŞňů│ŃÇéÚÇÜŔ┐çňż«šöčšëꊳľŔ░âŔŐéňż«šöčšëęšöčÚĽ┐´╝îŔâŻňĄčŠüóňĄŹń║║ńŻôňż«šöčŠÇü´╝îŠüóňĄŹňüąň║ĚŃÇ隍«ň돴╝îňż«šöčŠÇüŔŹ»šëęňŞéňť║šę║ÚŚ┤ŔÂů500ń║┐šżÄňůâ´╝¬Ŕç│2019ň╣┤´╝îŔÁŤÚüôš┤»Ŕ«íŔ׏ŔÁäŔÂů30ń║┐šżÄňůâŃÇé
ňŹĽš╗ćŔâ׊Áőň║ĆŠŐÇŠť»ŔâŻňĄčňĆĹŠÄśšĘÇŠťëšëęšžŹňč║ňŤáš╗ä´╝îň░抻Ćńެš╗ćŔĆîńŞÄňč║ňŤáŔíĘŔżżŔüöš│╗ŔÁĚŠŁą´╝îňŞ«ňŐęŠîľŠÄśňÇÖÚÇëŔĆîŠá¬ŃÇé
ňŤż12 ŔĆîŠá¬ŠîľŠÄśŠś»ňż«šöčŠÇüŔŹ»šëęšáöňĆĹšÜäŠáŞň┐â
´╝ł2´╝ëňŹĽš╗ćŔâ׊Áőň║ĆňŐęňŐŤňÉłŠłÉšöčšëęňşŽDBTLňż¬šÄ»´╝ÜňÉłŠłÉšöčšëęňşŽÚÇÜŔ┐çš╝ľšáüš╗ćŔâ×ňč║ňŤá´╝îŔ«ęš╗ćŔâ×ńŞ║ń║║š▒╗ňĚąńŻťń║žšöčŠâ│ŔŽüšÜäšëęŔ┤ĘŃÇ銏«McKinseyš╗čŔ«í´╝îňůĘšÉâ60%ń╗ąńŞŐšÜäňîľňşŽŠľ╣Š│ĽňłÂÚÇášÜäń║žňôüÚâŻňĆ»ń╗ąÚÇÜŔ┐çšöčšëęŠŐÇŠť»ňłÂÚÇáŃÇéňÉłŠłÉšöčšëęňşŽňłÖňĆ»ń╗ąňťĘń║║š▒╗ŔíúÚúčńŻĆŔí╣Šľ╣ÚŁóÚŁóŔ┐ŤŔíîň║öšöĘň╝ÇňĆĹňĺîń║žňôüŔÉŻňť░ŃÇéňÉłŠłÉšöčšëęňşŽňťĘňî╗šľŚňüąň║ĚÚóćňččšÜäň║öšöĘň╣┐Š│Ť´╝îŠÂëňĆŐš╗ćŔâ×ňůŹšľźšľŚŠ│ĽŃÇüRNAŔŹ»šëęŃÇüňż«šöčŠÇüšľŚŠ│ĽŃÇüňč║ňŤáš╝ľŔżĹšŤŞňů│ň║öšöĘŃÇüńŻôňĄľŠúÇŠÁőŃÇüňî╗šľŚŔÇŚŠŁÉŃÇüŔŹ»šëꊳÉňłćšöčń║žňĺîňłÂŔŹ»šöĘÚůšşëňĄÜŠľ╣ÚŁóŃÇéňÉłŠłÉšöčšëęňşŽńŞőŠŞŞń║žňôüňŞéňť║2024ň╣┤ň░ćŔÂůŔ┐ç180ń║┐šżÄňůâŃÇé
ňŤż13 ňÉłŠłÉšöčšëęňşŽňŞéňť║šę║ÚŚ┤
ňťĘŠôŹńŻťńŞŐ´╝îňÉłŠłÉšöčšëęňşŽň░ćňÇÖÚÇëňč║ňŤáš╝ľŔżĹňůąň║ĽšŤśšöčšëę´╝łń╗ąňż«šöčšëęńŞ║ńŞ╗´╝ë´╝îŠÁőŔ»ĽŔĆîŠá¬ŠÇžšŐÂňĆŐšöčšëęňÉłŠłÉŠĽłŠ×ť´╝îň╣Šîüš╗şń╝śňîľ´╝îŔÄĚňżŚňĆ»šöĘšÜäšëęšžŹŃÇéŔÇîňŹĽš╗ćŔâ׊Áőň║ĆÚÇÜŔ┐çÚźśÚÇÜÚçĆšşŤÚÇëŔĆîŠá¬´╝îŔâŻňĄčň╗║šźőňż«šöčšëęňč║ňŤáŃÇüňŐčŔâŻń┐íŠü»ň║ô´╝îšöĘń╗ąŠÉťš┤óňĺîń╝śňîľňÇÖÚÇëňč║ňŤá´╝îňŐáÚÇčDBTLňż¬šÄ»ŃÇé
ňŤż14 DBTLňż¬šÄ»ňĄžÚçĆŠÁőŔ»Ľš╝ľšáüŠĽłŠ×ť´╝îň┐źÚÇčňżŚňł░Úó䊝čšëęšžŹ
šŤ«ň돴╝îňŤŻňćůňŹĽš╗ćŔâ׊Áőň║Ćń╝üńŞÜšÖżŔŐ▒ÚŻÉŠöż´╝ëń║ŤńżžÚçŹń║ÄšžĹšáöŠťŹňŐí´╝ëń║ŤńŞôŠ│Ęń║ÄňĚąňůĚŃÇéń╗ąšžĹšáöŠťŹňŐíŔžüÚĽ┐šÜäń╝üńŞÜ´╝îňĆ»ń╗ąňťĘščşŠŚÂÚŚ┤ňćůň┐źÚÇčňüÜňĄžŔÉąŠöÂŔžäŠĘí´╝îńŻćÚĽ┐Ŕ┐ťŠŁąšťő´╝îňŤáńŞ║ńŞÄń╝áš╗蚞ŊŐÇŠťŹňŐíňĽćňŻóŠłÉŠ┐ÇšâłšÜäšź×ń║ë´╝îŔ┐ÖšžŹňĽćńŞÜŠĘíň╝Ćň»╣Ŕ┐ÉŔÉąŠĽłšÄçŠĆÉňç║ń║ćňĚĘňĄžšÜäŠîĹŠłśŃÇéň»╣ń║ÄńŞôŠ│ĘňťĘňŹĽš╗ćŔâ×ňĚąňůĚšÜäń╝üńŞÜŠŁąŔ»┤´╝îń╗ŹšäŠś»Šť║ÚüçńŞÄŠîĹŠłśň╣ÂňşśŃÇéňŤŻňćůňŞéňť║ňşśňťĘň»╣10xšÜäňŤŻń║žŠŤ┐ń╗úšÜ䊝║ń╝ÜŃÇ隞ŊťŹňĽćńŻťńŞ║10xŠťÇňĄžšÜäń╣░ň«Â´╝îňżŚÔÇťšžĹŠťŹŔÇůÔÇŁňżŚňĄęńŞőŃÇéšäÂŔÇî´╝ŊťŹňĽćň»╣ňĚąňůĚšÜäŠÇžń╗ĚŠ»öŠá╝ňĄľŠîĹňëö´╝îŔ┐Öň░▒ŔŽüŠ▒éňĚąňůĚš▒╗ń╝üńŞÜńŞÇň«ÜŔŽüš▓żšŤŐŠ▒éš▓ż´╝îňÄÜšž»ŔľäňĆĹŃÇéŔç│ń║ÄŠîĹŠłś´╝Śáöň║öšöĘÚŁóńŞ┤ňŞéňť║šÜäňĄęŔŐ▒ŠŁ┐´╝îňŽéńŻĽš¬üšá┤ŠłÉńŞ║ŠĹćňťĘňÉäńެń╝üńŞÜÚŁóň돚ÜäÚŚ«ÚóśŃÇ銝ëšÜäŠőôň▒Ľňôüš▒╗´╝łšę║ÚŚ┤š╗ä´╝ë´╝ëšÜäŠőôň▒Ľň║öšöĘ´╝łńŞ┤ň║ŐŔ»ŐŠľş´╝ë´╝îšöÜŔç│ŠťëšÜäňĆĹšÄ░ń║ćńŞÇň║žŠľ░šÜäÚçĹšč┐´╝łňż«šöčšëę´╝ë´╝îňĆ»Ŕ░ôňůźń╗ÖŔ┐çŠÁĚ´╝îňÉ䊜żšą×ÚÇÜŃÇé
ŠŚáŔ«║ňŽéńŻĽ´╝îňŹĽš╗ćŔâ׊Áőň║ĆňĚ▓š╗ĆŠÄÇŔÁĚńŞÇňť║ňůĘšÉâŔîâňŤ┤ňćůšÜ䚞ŚáöńŞÄŔ»ŐŠľşŠľ╣ň╝ĆńŞŐšÜäŔîâň╝ĆŔŻČšž╗ŃÇéÚÜĆšŁÇŠłÉŠťČŠî犼░š║žńŞőÚÖŹ´╝îň░ćňŞŽŠŁąńŞőŠŞŞňĄÜňť║ŠÖ»ń║ĽňľĚň╝ĆšłćňĆĹŃÇéňŹĽš╗ćŔâ׊ŐÇŠť»´╝îš╗łň░ćň╝ĽÚóćńŞÇňť║šöčňĹŻšžĹňşŽšÜäÚŁęňĹŻŃÇé
![]()
Šľ░Šá╝ňůâšöčšëꊳɚźőń║Ä2018ň╣┤´╝îńŞôŠ│ĘÚźśÚÇÜÚçĆňŹĽš╗ćŔâ×ňĄÜš╗äňşŽň╣│ňĆ░ń║žňôüšÜäŔç¬ńŞ╗ň╝ÇňĆĹňĆŐńŞ┤ň║ŐŔŻČňîľŃÇéňůČňĆŞŠłÉšźőňÉÄňĆĹň▒ĽŔ┐ůÚÇč´╝îšÄ░ňĚ▓ŠőąŠťëňŤŻÚÖůÚóćňůłšÜäńŞÇšźÖň╝ĆÚźśÚÇÜÚçĆňŹĽš╗ćŔâ׊Áőň║Ćň╣│ňĆ░´╝îŠĆÉńżŤń╗Äš╗äš╗çŠáĚŠťČňĄäšÉć´╝îÚźśÚÇÜÚçĆňŹĽš╗ćŔâ×ňłćšŽ╗ňĆŐŠÁőň║ĆŠľçň║ôŠ×äň╗║´╝îňł░ŠĽ░ŠŹ«ňłćŠ×ÉňĺîńŞ┤ň║ŐŠäĆń╣ëŠîľŠÄśšÜäňůĘÚŁóŔžúňć│Šľ╣ŠíłŃÇéšÄ░Šťëń║žňôüňîůŠőČŔç¬ńŞ╗ň╝ÇňĆĹšöčń║žšÜäŔç¬ňŐĘňîľňŹĽš╗ćŔâ׊Áőň║ĆŠľçň║ôŠ×äň╗║ń╗¬ňÖĘ´╝îÚźśÚÇÜÚçĆňŹĽš╗ćŔâ׊Áőň║ĆŔ»Ľňë隍ĺ´╝îÚŁÂňÉĹÚźśÚÇÜÚçĆňŹĽš╗ćŔâ׊Áőň║Ćń║žňôü´╝îšöčń┐íňłćŠ×ÉŔŻ»ń╗´╝îňĆŐňŹĽš╗ćŔâ׊Ľ░ŠŹ«ň║ôŃÇé
![]()
ňóĘňŹôšöčšëęń║Ä2018ň╣┤Ŕ»×šöčń║ÄňôłńŻŤŠáíňŤş´╝îšö▒ňôłńŻŤňĄžňşŽńŞëňÉŹňŹÜňúźŔüöňÉłňłŤšźő´╝îšżÄňŤŻńŞëÚÖóÚÖóňúźŃÇüDrop-seqŠŐÇŠť»ňĆĹŠśÄń║║David WeitzÚóćŔíöŃÇé2020ň╣┤8ŠťłňůĘšÉâŠÇ╗ÚâĘŔÉŻňť░ŠÁÖŠ▒čňśëňů┤´╝îňĆŽňťĘšżÄňŤŻŠ│óňúźÚí┐Ŕ«żŠťëňłŤŠľ░ńŞÄňĽćňŐíńŞşň┐âŃÇéňůČňĆŞŠáŞň┐âŠŐÇŠť»Š║ÉŔç¬ňôłńŻŤňĄžňşŽWeitzň«×Ú¬îň«Ą´╝îňč║ń║ÄšíČŠáŞňż«ŠÁüŠÄžŠŐÇŠť»ŠëôÚÇáňŹĽš╗ćŔâ׊Áőň║Ćň╣│ňĆ░´╝îŠĚ▒ŔÇĽšžĹšáöŃÇüŔŹ»šáöňĺîńŞ┤ň║ŐŔ»ŐŠľşńŞëňĄžň║öšöĘÚóćňččŃÇéňůČňĆŞňĚ▓ňĆĹňŞâÚźśÚÇÜÚçĆňŹĽš╗ćŔâ׊Áőň║ĆŔžúňć│Šľ╣Šíł´╝îńŞöńŞ║ňůĘšÉâňö»ńŞÇšÜäňĽćńŞÜňîľňż«šöčšëęňŹĽš╗ćŔâ׊Áőň║ĆŔžúňć│Šľ╣ŠíłŠĆÉńżŤňĽćŃÇé
![]()
šÖżňąąŠÖ║Š▒犳ɚźőń║Ä2018ň╣┤´╝»ńŞÇň«ÂňůĚŠťëňůĘšÉâŔžćÚçÄšÜäšöčšëęŠŐÇŠť»ń╝üńŞÜ´╝îňůČňĆŞňůĚňĄçňŤŻÚÖůň돊▓┐šÜäňŹĽš╗ćŔâ׊Áőň║ĆŠŐÇŠť»´╝îň╝ÇňĆĹń║ćň┐źÚÇčŃÇüÚźśŠĽłšÜäňŹĽš╗ćŔâך╗äňşŽňłćŠ×ÉŠľ╣Š│Ľ´╝îň╗║šźőń║ćňŤŻÚÖůńŞŐňůłŔ┐ŤšÜäňŹĽš╗ćŔâך╗äňşŽŠĽ░ŠŹ«ň║ôňĺîń║Ąń║ĺŠÇžňŹĽš╗ćŔâ׊Ľ░ŠŹ«ň▒ĽšĄ║ň╣│ňĆ░´╝îŠőąŠťëňĄÜÚí╣ňŹĽš╗ćŔâךöčšëęń┐íŠü»ŠŐÇŠť»ńŞôňłęŃÇéšÖżňąąŠÖ║Š▒çŔç┤ňŐŤń║ÄňŹĽš╗ćŔâ×ňč║ňŤáš╗äňşŽňĺîšöčšëęń┐íŠü»ňşŽňťĘń║║š▒╗šľżšŚůŔ»ŐŠľşňĺîŠ▓╗šľŚńŞŐšÜäň║öšöĘ´╝îňĆĹšÄ░Šľ░šÜäŠ▓╗šľŚňĺîŔ»ŐŠľşÚŁÂŠáçŃÇüňłŤŠľ░Š▓╗šľŚšşľšĽą´╝îňłŤň╗║ń║║š▒╗šľżšŚůšÜäš▓żňçćňŤżŔ░▒ŃÇé
![]()
ńŞçń╣śňč║ňŤáŠłÉšźőń║Ä2018ň╣┤´╝îŔç┤ňŐŤń║ÄÚççšöĘŠŤ┤ňůĚŠôŹńŻťńż┐ňłęŠÇžŃÇüŔ«żňĄçňŐčŔ⯊ǞňĺîŔ»ĽňëéŠőôň▒ĽŠÇžšÜäŠÂ▓Š╗┤ňż«ŠÁüŠÄžŠŐÇŠť»´╝îŠëôÚÇáŠőąŠťëňŤŻÚÖůňůłŔ┐ŤÚźśÚÇÜÚçĆňŹĽš╗ćŔâ×ňĄÜš╗äňşŽŠŐÇŠť»ň╣│ňĆ░ŃÇ隍«ň돴╝îńŞçń╣śňč║ňŤášÜäŠÂ▓Š╗┤ňż«ŠÁüŠÄžňŹĽš╗ćŔâ׊Áőň║Ćń╗¬Perseus´╝îňĺîÚůŹňąŚŠÄĘňç║šÜäÚźśÚÇÜÚçĆŔŻČňŻĽš╗äŔ»Ľňëé´╝îňĚ▓Ŕ┐ŤňůąňćůňĄľÚâĘŠÁőŔ»ĽÚśÂŠ«ÁŃÇé

ňżĚŔ┐Éň║ĚšĹ׊łÉšźőń║Ä2020ň╣┤´╝»ńŞÇň«ÂňůĘÚôżŠŁíňŹĽš╗ćŔâ×ńŞÄšę║ÚŚ┤ňĄÜš╗äňşŽŠŐÇŠť»ň╣│ňĆ░ň×őń╝üńŞÜ´╝îňťĘŔőĆňĚ×ŃÇüňÄŽÚŚĘŠőąŠťëŔÂů6000ň╣│š▒│šáöňĆĹńŞÄšöčń║žňč║ňť░ŃÇéňůČňĆŞÚ珚é╣ňŤ┤š╗ĽňŹĽš╗ćŔâ×ň»îÚŤćńŞÄŠúÇŠÁőŃÇüňŹĽš╗ćŔâ׊Áőň║ĆŃÇüšę║ÚŚ┤ňĄÜš╗äňşŽŠŐÇŠť»´╝îŠ╗íŔÂ│ńŞŹňÉîň║öšöĘňť║ŠÖ»ńŞőšÜäňłćŠ×ÉڝNJ▒é´╝ŤňůČňĆŞŔüܚ䎊ĜňťĘŔé┐šśĄš▓żňçćňî╗ňşŽŃÇüń╝śšöčń╝śŔé▓ňĺîŔŹ»šëęňĆĹšÄ░ÚóćňččšÜäňĚĘňĄžŠŻťňŐŤ´╝îŔç┤ňŐŤń║ÄŠÄĘňŐĘš▓żňçćňî╗šľŚňÉĹňŹĽš╗ćŔâ×ńŞÄšę║ÚŚ┤ňĄÜš╗äňşŽŠŚÂń╗úŔ┐łŔ┐Ť´╝îňŐęňŐŤšöčňĹŻšžĹňşŽňĺîńŞ┤ň║Őňî╗ňşŽ´╝îńŞ║ń║║š▒╗ňüąň║Ěń║őńŞÜŔ┤íšî«ńŞşňŤŻŠÖ║ŠůžŃÇé
ňĆéŔÇâŔÁ䊾ִ╝Ü
1. ńŞŐŠÁĚňÉëňç»ňč║ňŤá´╝îń╗ÄTop50ŠťčňłŐ2000ńŻÖš»çŠľçšî«´╝îšťőňŹĽš╗ćŔâ׊Áőň║Ćšâşšé╣ňĺîňĆĹŠľçÚöŽňŤŐ
2. Ark-Invest´╝îAI Training Costs Are Improving at 50x the Speed of MooreÔÇÖs Law
3. ŠîĹňťłŔüöÚŁá´╝îňŹĽš╗ćŔâ׊Áőň║ĆŠşúŠÁüŔíî´╝üňŞłňžÉšźčšöĘň«âňĆĹń║ćIF 10+šÜ䊾皟á
4. Exponential scaling of single-cell RNA-seq in the past decade
5. Highly Parallel Genome-wide Expression Profiling of Individual Cells Using Nanoliter Droplets
6. ńŞŐŠÁĚňÉëňç»ňč║ňŤá´╝îňŹĽš╗ćŔâ׊ĚĚŠáĚŠÁőň║ĆÔÇöÔÇöň░Ćš╗ĆŔ┤╣ń╣čŔâŻŔŻ╗ŠŁżňĆĹŔíĘ5ňłćŠľçšźá´╝ü
7. šÖżňąąŠÖ║Š▒ç´╝îňŹĽš╗ćŔâ׊Áőň║ĆňťĘŔŹ»šëęšáöňĆĹňĺîńŞ┤ň║Őň«×Ú¬îńŞşšÜäň║öšöĘ
8. High-throughput, single-microbe genomics with strain resolution, applied to a human gut microbiome
9. ň╣┐Ŕ»üŠüĺšöč´╝îŔžüÔÇťňż«ÔÇŁščąŔĹŚÔÇöňż«šöčŠÇüŔŹ»šëꊜąŔŐŻňłŁŔîü´╝úňÇ╝ňŞâň▒ÇŔ뻊ť║
ňůŹŔ┤úňú░ŠśÄ
šŤŞňů│ňćůň«╣ňč║ń║ÄňĚ▓ňůČň╝ÇšÜäŔÁ䊾֊łľń┐íŠü»Šĺ░ňćÖ´╝îńŻćŠťČňůČňĆŞńŞŹń┐ŁŔ»üŔ»ąšşëń┐íŠü»ňĆŐŔÁ䊾֚Üäň«îŠĽ┤ŠÇžŃÇüňçćší«ŠÇž´╝îŠëÇňÉźń┐íŠü»ňĆŐŔÁ䊾Öń┐ŁŠîüňťĘŠťÇŠľ░šŐŠÇüŃÇéňÉ´╝ČňůČňĆŞŠťëŠŁâň»╣ŠťČŠŐąňĹŐŠëÇňÉźń┐íŠü»ňťĘńŞŹňĆĹňç║ÚÇÜščąšÜäŠâůňŻóńŞőňüÜňç║ń┐«Šö╣´╝îÚśůŔ»╗ŔÇůň║öňŻôŔç¬Ŕíîňů│Š│ĘšŤŞň║öšÜ䊍┤Šľ░Šłľń┐«Šö╣ŃÇé
ňťĘń╗╗ńŻĽŠâůňćÁńŞő´╝Ț»çŠľçšźáńŞşšÜäń┐íŠü»ŠłľŠëÇŔíĘŔ┐░šÜäŠäĆŔžüňŁçńŞŹŠ×䊳Éň»╣ń╗╗ńŻĽń║║šÜäŠŐĽŔÁäň╗║Ŕ««´╝áŔ«║Šś»ňÉŽňĚ▓š╗ĆŠśÄšĄ║ŠłľŠÜŚšĄ║´╝ȊչňĹŐńŞŹŔâŻńŻťńŞ║Úüôń╣ëšÜäŃÇüŔ┤úń╗╗šÜäňĺîŠ│ĽňżőšÜäńżŁŠŹ«ŠłľŔÇůňçşŔ»üŃÇéňťĘń╗╗ńŻĽŠâůňćÁńŞő´╝ČňůČňĆŞń║ŽńŞŹň»╣ń╗╗ńŻĽń║║ňŤáńŻ┐šöĘŠťČŠľçšźáńŞşšÜäń╗╗ńŻĽňćůň«╣ŠëÇň╝ĽŔç┤šÜäń╗╗ńŻĽŠŹčňĄ▒Ŕ┤čń╗╗ńŻĽŔ┤úń╗╗ŃÇ銝Ȋľçšźáń╗ůńŞ║ŠťČňůČňĆŞŠëÇŠťë´╝¬š╗Ćń║őňůłń╣ŽÚŁóŔ«ŞňĆ»´╝îń╗╗ńŻĽŠť║Š×äňĺîńެń║║ńŞŹňżŚń╗ąń╗╗ńŻĽňŻóň╝Ćš┐╗šëłŃÇüňĄŹňłÂŃÇüňĆĹŔíĘŃÇüŔŻČňĆĹŠłľň╝ĽšöĘŠťČŠŐąňĹŐšÜäń╗╗ńŻĽÚâĘňłćŃÇé