IPF全球首创肺前体细胞新药II期临床试验启动会成功召开 | 点石伙伴
2023年6月17日瑞泰生物艾普柯®Epicon A®巩膜镜正式获批上市,填补中国眼科临床治疗空白 | 点石伙伴
2023年6月21日
核药,即放射性药物,由放射性同位素与有机分子组合而成,根据用途可分为诊断型核素药物和治疗型核素药物:
1. 诊断型核药常采用发射γ射线的放射性同位素,能被特定仪器SPECT/PET检测到,常在一天后从体内完全清除,主要应用于无创精准靶向全身动态诊断、影像病况分级、用药效果评估等。
2. 治疗型核药采用发射短程的α或者β粒子,通过参与代谢过程或经标记分子引导,在病变组织聚集并进行辐照,对局部的病变细胞产生DNA损伤,从而抑制或破坏病变组织发挥治疗作用,这类同位素在体内常停留几天来发挥治疗效果。
目前常见的诊断用药主要品种包括氟[18F]标记药物、锝[99mTc]标记药物等,治疗用药包括碘[131I]化钠、碘[125I]密封籽源、镥[177Lu]标记药物等。
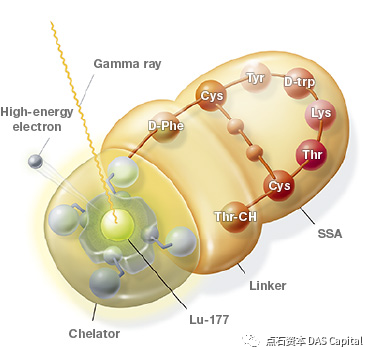
 随着治疗型核药的逐渐兴起,靶向放射性核素疗法(Targeted Radionuclide Therapy ,TRT)成为了目前靶向治疗最具潜力的发展方向之一。TRT主要由起靶向定位作用的小分子或多肽(Ligand)、连接臂(Linker)、螯合物(Chelator)和放射性同位素四个部分构成。TRT通过特异性的小分子或多肽靶向病变细胞的受体或识别标记,将放射性核素带到病变细胞周围,产生的放射性射线能量可以杀死快速分裂和生长的病变细胞。其在肿瘤治疗领域已有许多应用,包括复发或难治性前列腺癌、肝细胞癌、转移性骨肿瘤、甲状腺癌、毛细血管瘤等。
随着治疗型核药的逐渐兴起,靶向放射性核素疗法(Targeted Radionuclide Therapy ,TRT)成为了目前靶向治疗最具潜力的发展方向之一。TRT主要由起靶向定位作用的小分子或多肽(Ligand)、连接臂(Linker)、螯合物(Chelator)和放射性同位素四个部分构成。TRT通过特异性的小分子或多肽靶向病变细胞的受体或识别标记,将放射性核素带到病变细胞周围,产生的放射性射线能量可以杀死快速分裂和生长的病变细胞。其在肿瘤治疗领域已有许多应用,包括复发或难治性前列腺癌、肝细胞癌、转移性骨肿瘤、甲状腺癌、毛细血管瘤等。
TRT作为偶联药物领域的新成员,与ADC有部分的相似之处,也有截然不同的差异:
1. 靶向定位:TRT配体一般选择多肽、小分子,相比于ADC的抗体而言具有更短的半衰期,因此清除速率更快,代谢毒性更低。2. 药物载荷:TRT的载荷不再是ADC药物所使用的毒性分子,而改为了放射性核素。核素产生的射线穿透力和杀伤力更强,使得核药在体内的具有更高的安全性、稳定性和有效性。3. Linker:其Linker在起效过程中无需像ADC药物一样断裂。
4. 作用机制:ADC需要通过内吞发挥杀伤作用,因此ADC往往受限于特定的细胞膜受体。而TRT凭借核素的高穿透性,免去了胞吞过程,得以在胞外进行杀伤,大大拓宽了可成药靶点和适应症范围,使得药物具有广谱杀伤作用。除了直接杀伤外,TRT还能通过旁观者效应、交叉火力效应甚至远端效应,对癌变细胞产生额外杀伤。
- 旁观者效应:ADC抗体与连接子之间的氢键以及连接子本身的稳定性较弱,对肿瘤周围细胞的杀伤能力即旁观者效应相对较低,而TRT由于螯合物的存在能轻松与配体偶联形成强共价键,在结构稳定性上具有天然优势,能有效增强旁观者效应,疗效更佳。
- 交叉火力效应:一个粒子对多个邻近细胞造成损伤的能力,这在异质性肿瘤中具有优势。
- 远端效应:在对特定肿瘤部位进行局部辐射时,能够引起非辐射范围的肿瘤体积出现明显缩小甚至消失。
5. 耐药性:TRT依靠直接的核素内辐射,可降低肿瘤细胞的放射抵抗的耐药机会。
即便存在“核辐射”顾虑,这些特殊优势也决定了核药是精准医疗不可替代的重要部分。综上所述,核药具有的独特优势将有潜力带来更大的临床获益。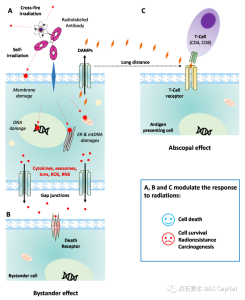 1.1.2 诊疗一体化有望同步实现可视化和精准治疗
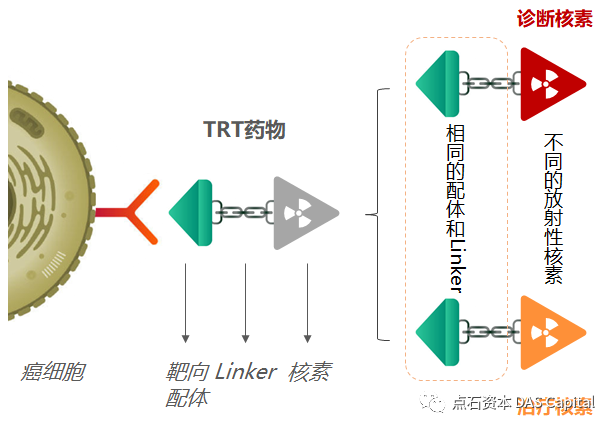
TRT的结构可以简化为“配体—Linker—螯合物—核素”的模型,而末端的核素具有极大的灵活性,同样的受体可以结合各种各样的核素,形成不同的TRT。这就好比一把多功能螺丝刀,可根据不同的需求和应用场景更换不同的刀头,发挥不同的作用。这种特点赋予了TRT诊断与治疗一体化的可能性。传统方案需要通过影像学、病理学等手段诊断肿瘤,结果出具时间长并且依赖于医生经验,容易出现误诊漏诊的情况。
诊疗一体的TRT通过螯合不同类型的核素达到诊断或治疗的目的,诊断用核素包括68Ga, 64Cu等,治疗用核素包括177Lu、67Cu等。由于使用的配体和Linker都完全相同,诊断和治疗配对的TRT在体内的分布高度相似,能够真正做到“看到即达到”,特异性和灵敏度极高,大大提高了诊疗效率和准确率。
1.1.2 诊疗一体化有望同步实现可视化和精准治疗
TRT的结构可以简化为“配体—Linker—螯合物—核素”的模型,而末端的核素具有极大的灵活性,同样的受体可以结合各种各样的核素,形成不同的TRT。这就好比一把多功能螺丝刀,可根据不同的需求和应用场景更换不同的刀头,发挥不同的作用。这种特点赋予了TRT诊断与治疗一体化的可能性。传统方案需要通过影像学、病理学等手段诊断肿瘤,结果出具时间长并且依赖于医生经验,容易出现误诊漏诊的情况。
诊疗一体的TRT通过螯合不同类型的核素达到诊断或治疗的目的,诊断用核素包括68Ga, 64Cu等,治疗用核素包括177Lu、67Cu等。由于使用的配体和Linker都完全相同,诊断和治疗配对的TRT在体内的分布高度相似,能够真正做到“看到即达到”,特异性和灵敏度极高,大大提高了诊疗效率和准确率。
 1.1.3 个性化治疗助推精准医学发展对于患者而言,病情的轻重和个体间的差异往往成为影响用药和疗效的重要原因。而不同患者对于药物的耐受力也大相径庭,这给医生在开处方时出了一道难题。TRT可以相对量化病人的个体差异,在给药后能够计算出患者的吸收剂量,基于其“灵活换刀头”的特性,医生可较为容易地针对这些差异提供个体化的治疗方案,根据不同的情况给予患者不同的核素组合、使用不同的给药剂量以及进行不同周期的治疗等方式,尽可能做到个体疗效最大化。
核药的使用最早可追溯到一个世纪之前。在早期发展阶段,核药的存在形态为核素,人们直接利用核素进行诊断和治疗,而传统方法治疗疾病尤其是实体瘤需要高剂量的辐射,在治疗的同时会对正常组织造成伤害,因此人们对于治疗型核药的安全性一直存在担忧。
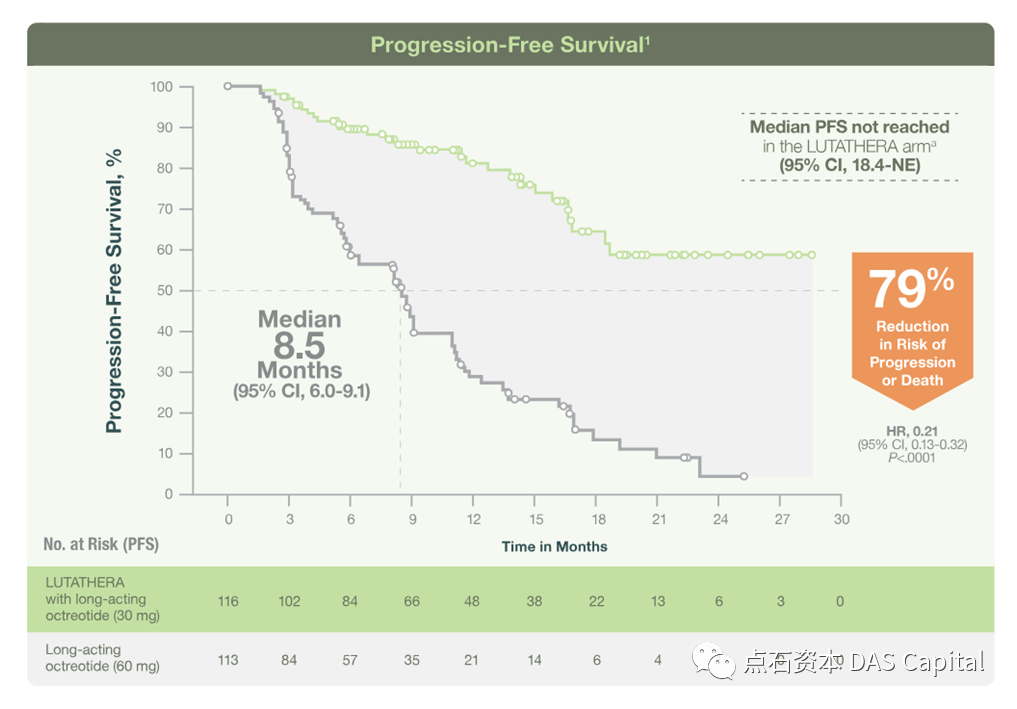
近十年来以RGD为代表的多肽核药成为研究热点,多种小分子非靶向性核药先后获批上市,掀起了一波治疗型核药小高潮。直到具有里程碑意义的2018年,Novartis的重磅药物177Lu-DOTATATE(Lutathera)获FDA批准用于治疗胃肠胰神经内分泌肿瘤。
在临床研究中,Lutathera与现有治疗方案奥曲汀相比,低肝脏肿瘤负担组中位PFS达到了28.35个月 vs 11.04个月;高肝脏肿瘤负担组更是达到了中位PFS 19.38个月 vs 5.52个月。同时,靶向的精准性可以用较小的辐射剂量获得较好的治疗效果,具有很好的效力/风险比。优异的临床表现也使其被纳入了欧洲神经内分泌学会指南中的一线治疗方案。
1.1.3 个性化治疗助推精准医学发展对于患者而言,病情的轻重和个体间的差异往往成为影响用药和疗效的重要原因。而不同患者对于药物的耐受力也大相径庭,这给医生在开处方时出了一道难题。TRT可以相对量化病人的个体差异,在给药后能够计算出患者的吸收剂量,基于其“灵活换刀头”的特性,医生可较为容易地针对这些差异提供个体化的治疗方案,根据不同的情况给予患者不同的核素组合、使用不同的给药剂量以及进行不同周期的治疗等方式,尽可能做到个体疗效最大化。
核药的使用最早可追溯到一个世纪之前。在早期发展阶段,核药的存在形态为核素,人们直接利用核素进行诊断和治疗,而传统方法治疗疾病尤其是实体瘤需要高剂量的辐射,在治疗的同时会对正常组织造成伤害,因此人们对于治疗型核药的安全性一直存在担忧。
近十年来以RGD为代表的多肽核药成为研究热点,多种小分子非靶向性核药先后获批上市,掀起了一波治疗型核药小高潮。直到具有里程碑意义的2018年,Novartis的重磅药物177Lu-DOTATATE(Lutathera)获FDA批准用于治疗胃肠胰神经内分泌肿瘤。
在临床研究中,Lutathera与现有治疗方案奥曲汀相比,低肝脏肿瘤负担组中位PFS达到了28.35个月 vs 11.04个月;高肝脏肿瘤负担组更是达到了中位PFS 19.38个月 vs 5.52个月。同时,靶向的精准性可以用较小的辐射剂量获得较好的治疗效果,具有很好的效力/风险比。优异的临床表现也使其被纳入了欧洲神经内分泌学会指南中的一线治疗方案。
 在此之后,诺华开足马力乘胜追击,于2018年以总值21亿美元收购了核药公司Endocyte,获得其小分子靶向放疗前列腺癌药物177Lu-PSMA-617(Pluvicto),凭借其成熟的团队与技术平台,迅速取得领先优势。Pluvicto于2022年获FDA批准上市,用于治疗PSMA阳性转移去势抵抗性前列腺癌(mCRPC)。其通过高亲和力配体结合前列腺特异性膜抗原(PSMA),该抗原在转移性去势抵抗性前列腺癌(mCRPC)患者中的表达水平高达80%,且其它正常细胞不表达,因此能够最大限度地避免对健康细胞的影响。
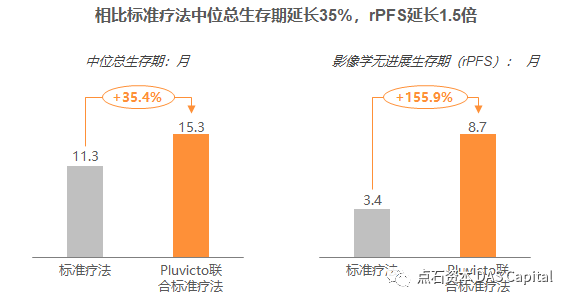
在此之后,诺华开足马力乘胜追击,于2018年以总值21亿美元收购了核药公司Endocyte,获得其小分子靶向放疗前列腺癌药物177Lu-PSMA-617(Pluvicto),凭借其成熟的团队与技术平台,迅速取得领先优势。Pluvicto于2022年获FDA批准上市,用于治疗PSMA阳性转移去势抵抗性前列腺癌(mCRPC)。其通过高亲和力配体结合前列腺特异性膜抗原(PSMA),该抗原在转移性去势抵抗性前列腺癌(mCRPC)患者中的表达水平高达80%,且其它正常细胞不表达,因此能够最大限度地避免对健康细胞的影响。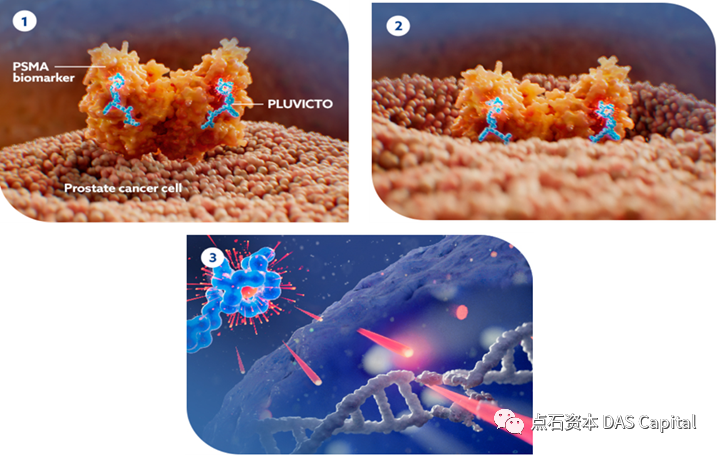 mCRPC患者的预后较差,5年生存率约为30%,并且对免疫疗法响应有限,被称为“冷肿瘤”,长期以来一直缺乏合适的治疗手段。Pluvicto通过近距离局部辐射能够释放肿瘤新生抗原,使前列腺肿瘤微环境变“热”,为免疫疗法铺路。三期临床研究结果显示,相比于标准疗法,Pluvicto联合标准疗法治疗组患者的中位总生存期延长35%,影像学无进展生存期延长1.5倍,死亡风险降低38%。
mCRPC患者的预后较差,5年生存率约为30%,并且对免疫疗法响应有限,被称为“冷肿瘤”,长期以来一直缺乏合适的治疗手段。Pluvicto通过近距离局部辐射能够释放肿瘤新生抗原,使前列腺肿瘤微环境变“热”,为免疫疗法铺路。三期临床研究结果显示,相比于标准疗法,Pluvicto联合标准疗法治疗组患者的中位总生存期延长35%,影像学无进展生存期延长1.5倍,死亡风险降低38%。
凭借优异的临床表现,Pluvicto第一年实际销售额为达2.71亿美元,是预期的6.3倍,2023年Q1收入2.11亿美元,自2022年3月上市后首年季度销量增速高达347%,累计销售额为4.82亿美元,诺华预计年销售峰值将超20亿美元。Pluvicto的优异表现给靶向核素疗法市场带来了强大的信心,预计靶向治疗型核药市场年复合增长率可达到40%以上。
2.1.2 先头药榜样效应持久,TRT核药管线推进如火如荼
有了老大哥诺华的身先士卒,TRT的研发达到了空前的热潮,不少国内药企和biotech纷纷入局TRT赛道,如恒瑞、东诚、先通、晶核、蓝纳成、辐联、药明博锐等,正积极推进临床前研究和临床试验,大大加速了核药的发展脚步。其中,现在各个药企在靶点PSMA的表现最为亮眼。2022年10月,先通医药的一类新药[177Lu]Lu-XT033注射液临床试验IND申请获得受理。2023年5月,蓝纳成新加坡子公司177Lu-LNC1003获得FDA药品临床试验批准通知书。晶核生物177Lu- JH02已递交中美IND,并于 2023年6月获FDA批准,成为首家在TRT领域获得FDA IND批准的国内企业。由此可见,PSMA是TRT领域炙手可热的靶点,企业希望通过Pluvicto的靶点验证自身研发平台的可靠性和内部推进体系的可行性,有助于帮助未来的新靶点、新适应症走上快车道。除此之外,胰腺癌、脑胶质瘤等“珠峰”也有待被TRT所攻克。可以预见,未来几年将会是TRT发展的黄金时代,数以万计的患者有望获得新的疗法从而重获新生。
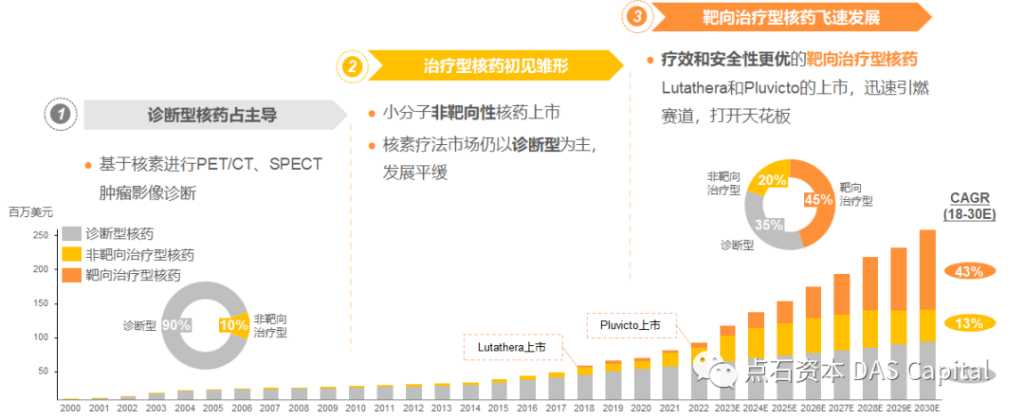
纵观整个核药市场的发展和演变,一共可以分成三个阶段。首先是随着放射性同位素的发现,诊断型核药开始用于进行影像诊断。第二阶段是小分子非靶向核药开始出现,治疗型核药初见雏形,鉴于当时核药的上下游配置、非靶向性、适应症分布、治疗效果等问题,发展比较平缓,早期治疗型核药仅占10%左右。而诺华两款TRT(Lutathera和Pluvicto)的上市,标志着核药开始向治疗倾斜,市场份额迅速扩大,预计到2030年,TRT市场占有率将达到45%,非靶向治疗型核药占有20%,合计为65%,核药市场将出现治疗型为主、诊断型为辅的局面。
 2.2 星星之火初燎原:新赛道进一步拓宽,资本持续关注加码
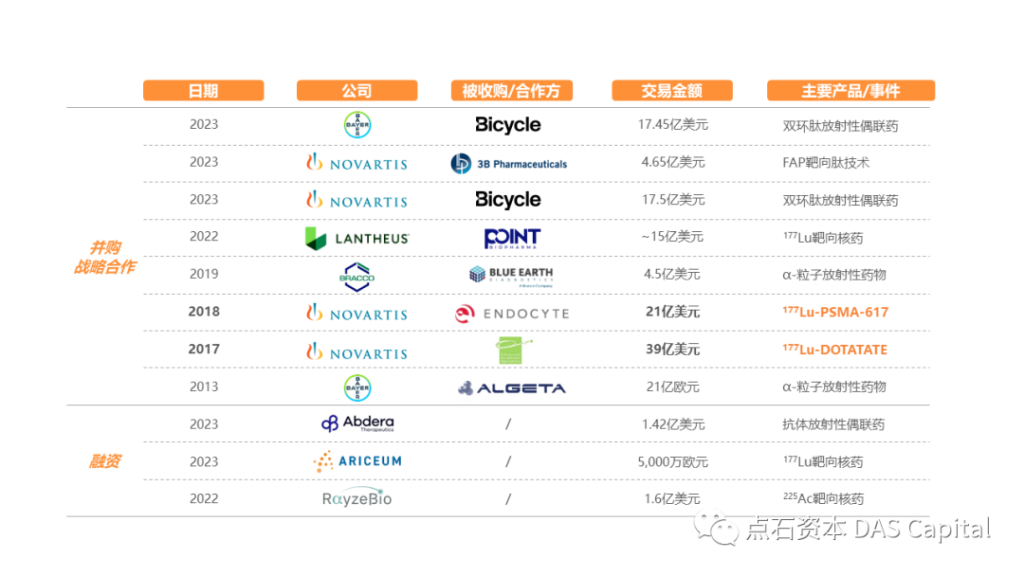
近几年,TRT的发展逐渐引起重视。诺华通过收购AAA和Endocyte,成为TRT的领先企业之后,多家跨国医药企业如拜耳也逐渐开始发展TRT业务,也涌现出Abdera、Ariceum等专注于TRT的Biotech公司,发生多起大金额的投资并购、战略合作事件。
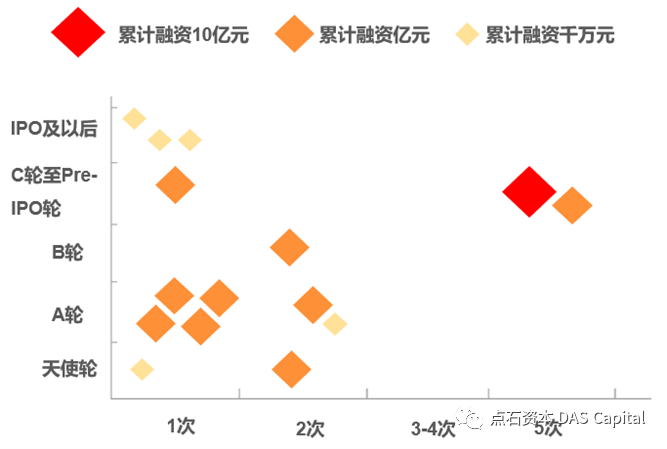
据统计,中国核药领域共有69家投资机构布局,一共完成了30笔融资,融资总额超过31.65亿人民币。尽管2022年起创新药大盘在资本市场遇冷,然而TRT却逆流而上,2022年全年融资近9亿人民币,多家初创企业获得大额投资,表明市场认为TRT爆发拐点已到,对TRT未来的临床和商业化价值高度看好。
2.2 星星之火初燎原:新赛道进一步拓宽,资本持续关注加码
近几年,TRT的发展逐渐引起重视。诺华通过收购AAA和Endocyte,成为TRT的领先企业之后,多家跨国医药企业如拜耳也逐渐开始发展TRT业务,也涌现出Abdera、Ariceum等专注于TRT的Biotech公司,发生多起大金额的投资并购、战略合作事件。
据统计,中国核药领域共有69家投资机构布局,一共完成了30笔融资,融资总额超过31.65亿人民币。尽管2022年起创新药大盘在资本市场遇冷,然而TRT却逆流而上,2022年全年融资近9亿人民币,多家初创企业获得大额投资,表明市场认为TRT爆发拐点已到,对TRT未来的临床和商业化价值高度看好。
 与普通药物不同,核药由于存在放射性,国家层面的监管也更加严格复杂。从核药的研发生产,到仓储运输、销售使用等环节都需要严格遵循对应的法规条例,国家先后出台了《中华人民共和国药品管理法》、《中华人民共和国药品管理法实施条例》等一般性规定,以及《放射性药品管理办法》、《中华人民共和国放射性污染防治法》、《放射性同位素与射线装置安全和防护条例》、《放射性同位素与射线装置安全许可管理办法》、《放射性物品运输安全管理条例》、《国家药监局关于进一步加强放射性药品管理有关事宜的通告》等专项条例,确保核药全流程的合法合规。
近几年,我国加大了对核药的支持力度,尤其在政策层面予以了大力支持。2019年,《药品管理法》建立上市许可人制度,激发核药市场活力;2021年,药审中心组织制定了《放射性体内诊断药物非临床研究技术指导原则》,同年《医用同位素中长期发展规划(2021-2035年)》出台,也是我国首个针对核技术在医疗卫生应用领域发布的纲领性文件,鼓励关键同位素核心技术取得突破;2023年,国家药监局药审中心发布《放射性体内治疗药物临床评价技术指导原则》,进一步打通核药的临床研发路径,越来越多的体内治疗核药也将陆续迈入临床。
与普通药物不同,核药由于存在放射性,国家层面的监管也更加严格复杂。从核药的研发生产,到仓储运输、销售使用等环节都需要严格遵循对应的法规条例,国家先后出台了《中华人民共和国药品管理法》、《中华人民共和国药品管理法实施条例》等一般性规定,以及《放射性药品管理办法》、《中华人民共和国放射性污染防治法》、《放射性同位素与射线装置安全和防护条例》、《放射性同位素与射线装置安全许可管理办法》、《放射性物品运输安全管理条例》、《国家药监局关于进一步加强放射性药品管理有关事宜的通告》等专项条例,确保核药全流程的合法合规。
近几年,我国加大了对核药的支持力度,尤其在政策层面予以了大力支持。2019年,《药品管理法》建立上市许可人制度,激发核药市场活力;2021年,药审中心组织制定了《放射性体内诊断药物非临床研究技术指导原则》,同年《医用同位素中长期发展规划(2021-2035年)》出台,也是我国首个针对核技术在医疗卫生应用领域发布的纲领性文件,鼓励关键同位素核心技术取得突破;2023年,国家药监局药审中心发布《放射性体内治疗药物临床评价技术指导原则》,进一步打通核药的临床研发路径,越来越多的体内治疗核药也将陆续迈入临床。
“乱世之中,能者居之”。随着众多初创企业崭露头角,核药赛道的竞争也日趋激烈,想要在一众竞争者中脱颖而出,核心技术是基础,突出亮点才是破局之道。为了理解核药市场,有必要理解整个行业的上下游情况:核药行业的产业链上游是原材料供应商,主要包括放射性同位素原材料以及其他合成配体;中游是放射性药物的研发与生产企业,是放射性药物生产技术的所有者,负责药品的研发、生产和销售;下游是药品的销售渠道以及相关医疗单位的核医学科室。
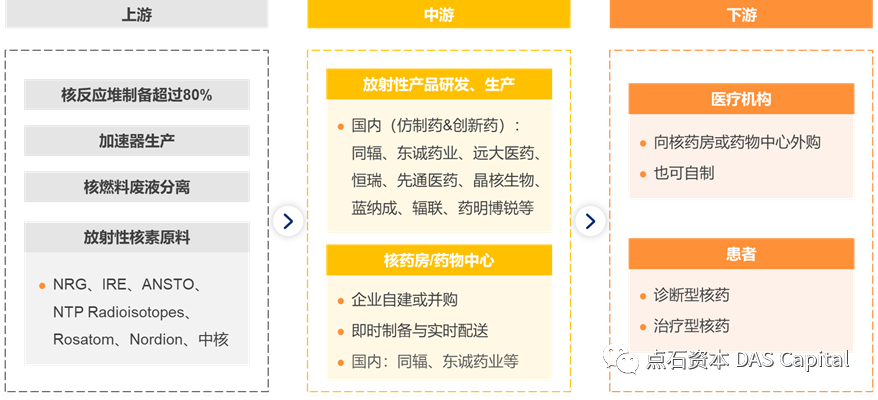
对于产业链上游,放射性同位素制备技术壁垒高,生产难度大,伴随核药产业链的全面完善,核素国产化的进程正在加速,一方面是积极寻求渠道扩大核素来源,例如中国同辐已与德国ITM签订合作协议,为中国市场提供68Ga、177Lu等新型放射性核素。另一方面是加快布局自主同位素生产,中国工程物理研究院核物理与化学研究所(简称九院二所)绵阳反应堆,已经实现常用医用同位素的规模化和国产化。
对于产业链下游,核心在于药品的物流和配送,而这其中的关键是核药房的全国网络化布局。东诚和同辐是国内核药房的两大主力军。以东诚为例:2016年,东诚通过收购GMS(中国)获得7家核药房,2018年收购安迪科,将其旗下7家已投入使用的核药房也收入囊中。东诚的布局策略是沿着黑河-腾冲人口分布线以东加速设置核药房。截止至2023年3月,东诚在全国范围内有27家核药房投入生产,另有11家核药房在建。据统计,全国正式生产和在建的核药房总数超过60家。
对于产业链中游,核药的天平已经向治疗方向倾斜,TRT是下一个必争之地,而TRT赛道的玩家们尚处于百花齐放、百家争鸣的阶段。平等的局面往往也意味着平等的机会,各玩家可以充分挖掘自身优势,“八仙过海,各显神通”,做到差异化竞争,从而快速抢占市场,脱颖而出。需要从以下几个角度评价TRT研发公司:
1. 管线布局:管线需要有明确的临床价值,Pluvicto有能力覆盖80%的mCRPC患者,做了很好的榜样;
2. 团队经验:拥有治疗型核药开发经验的核心团队在整个研发过程中至关重要。诺华之所以能够在2年时间内快速建立起来先发优势,核心就在于其收购了AAA以及Endocyte的技术团队与研发平台,深厚的技术积淀形成了竞争者们难以快速企及的护城河。
3. 管线推进速度:“文无第一,武无第二”,管线率先推进临床试验、率先获批上市,成功的机率将大大增加。
4. 差异化创新能力:新技术平台、新靶点和新适应症拓展和产业上下游整合等,都将是玩家们建立独家优势的不二选择。
中游这一环节是我们认为投资者重点关注的环节,国内外核药企业将交出怎样的答卷,我们拭目以待。
4.1 先通医药

先通医药成立于2005年,从2014年起,先通医药与美国、欧洲等国际领先的放射药企业及科研院所进行合作,先后取得了多个放射药产品的中国及全球的开发及商业化权利。同时根据放射药领域的发展现状,确定自主创新的研发产品线,产品涉及神经退行性病变及肿瘤、心血管等领域的精准诊断和靶向治疗药物。为了在核医学及分子影像产业链上下游布局,公司在江苏、广东、四川等地筹建分子影像基地,这些基地将要建成符合国际cGMP标准的、国内领先的、集靶向前体药物研发、放射性药物标记、核医学临床影像诊断、教育培训为一体的国际化核医学放射药产业基地。2022年10月,先通医药的一类新药[177Lu]Lu-XT033注射液临床试验IND申请获得受理。先通医药累计融资约13亿人民币,投资方包括中金资本、荷塘创投等。
4.2 晶核生物

晶核生物成立于2021年,是一家专注于可视化诊疗一体靶向放射性核素疗法(TRT)开发的生物医药企业,拥有靶向配体筛选、放射性药物偶联、药物临床转化三大技术平台,数个在研药物管线并进。联合创始人曾在Endocyte主导推进引发全球TRT热潮的Pluvicto项目,使得晶核成为国内少有的具有治疗型核药自主研发能力的企业。晶核生物的第一条管线177Lu- JH02 IND已递交中美双报,并于近日获得FDA批准,成为国内首家在TRT领域获得FDA IND许可的企业。晶核生物在一年内完成两轮累计数亿元融资,投资方包括凯泰资本、高榕资本、骊宸投资等。
4.3 蓝纳成

蓝纳成是东诚药业的核药创新研发平台,由东诚药业和陈小元教授联合创立于2021年,依托伊文思蓝(EB)纳米专利技术,进行1.1类放射性诊疗一体化创新药物的研发。2023年5月,蓝纳成新加坡子公司177Lu-LNC1003获得FDA药品临床试验批准通知书。此外,诊断核药氟[18F]思睿肽注射液已获批CDE IND。东诚药业集团股份有限公司成立于1998年,于2012年在深交所上市,股票代码002675.SZ,当前市值约为127亿元。公司生产药品覆盖生化原料药、中成药、化药、放射性药物四大领域。在放射性药物领域,公司自2015年开始积极收购相关企业,旗下的核药企业包括云克药业、上海欣科(广东希埃)、北京森科、益泰医药、安迪科。
辐联医药成立于2021年,是一家综合性的国际化放射性治疗公司,总部位于上海,在欧洲、美国均设有办事处。2022年11月,辐联医药收购Focus-X Therapeutics,强化以多肽为配体的放射药物研发管线。2023年 5月,辐联医药在比利时购买土地用于建设符合GMP标准的放射性药物生产设施。辐联医药累计融资约5千万美元,投资方包括红杉中国、楹联健康基金、辰德资本等。
博锐创合创立于2018年,是由药明康德和北大苏南研究院共同发起成立的合资公司,专注于放射性核素靶向药物的研发及临床应用,现建有苏州总部与研发中心、北京运营中心,并正在筹建中试及生产基地。2023年6月7日,博锐创合的[18F]BF3-BPA注射液的IND获CDE受理,为原发性和转移性脑部肿瘤的PET示踪剂。
2、 Radioimmunotherapy in Oncology: Overview of the Last Decade Clinical Trials
3、 Koppe, M. J., Postema, E. J., Aarts, F., Oyen, W. J. G., Bleichrodt, R. P., & Boerman, O. C. (2005). Antibody-guided radiation therapy of cancer. Cancer and Metastasis Reviews, 24(4), 539–567.
8、 Radiopharmaceutical therapy in cancer clinical advances and challenges, Nat Rev Drug Discov, 2020, 19, 589–608
10、 医用同位素中长期发展规划(2021-2035年)







 mCRPC患者的预后较差,5年生存率约为30%,并且对免疫疗法响应有限,被称为“冷肿瘤”,长期以来一直缺乏合适的治疗手段。Pluvicto通过近距离局部辐射能够释放肿瘤新生抗原,使前列腺肿瘤微环境变“热”,为免疫疗法铺路。三期临床研究结果显示,相比于标准疗法,Pluvicto联合标准疗法治疗组患者的中位总生存期延长35%,影像学无进展生存期延长1.5倍,死亡风险降低38%。
mCRPC患者的预后较差,5年生存率约为30%,并且对免疫疗法响应有限,被称为“冷肿瘤”,长期以来一直缺乏合适的治疗手段。Pluvicto通过近距离局部辐射能够释放肿瘤新生抗原,使前列腺肿瘤微环境变“热”,为免疫疗法铺路。三期临床研究结果显示,相比于标准疗法,Pluvicto联合标准疗法治疗组患者的中位总生存期延长35%,影像学无进展生存期延长1.5倍,死亡风险降低38%。