前言
颗粒物无处不在,检测分析有跨行业赛道属性。
颗粒物检测分析的场景广泛,上得科研的厅堂,下得生产制造的车间。
真正的技术创新时代,以及监管进入密集制定期,是颗粒物检测分析赛道的强大驱动力。
随着科技发展,微观世界研究愈发重要,颗粒物检测分析已经成为包括医疗健康,材料科学,半导体和新能源在内的新兴赛道的基本研究课题,该赛道具备跨行业的基本属性。颗粒分析的准确性直接影响着产品的质量、生产流程的优化以及创新发展的推动。随着制造工艺的不断进步和产品要求的不断提高,以及新技术的出现和赋能,对颗粒物分析仪器的需求也愈加迫切。
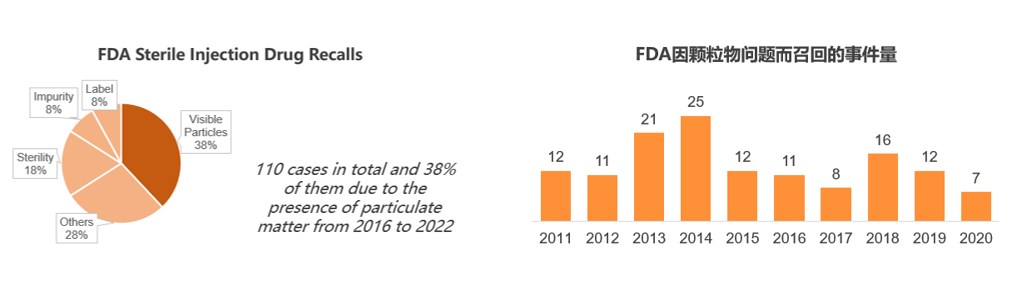
自2016到2022年间,颗粒物问题是FDA灭菌注射类药品召回的首要原因,其比例高达38%。
2019年9月,武田制药的明星产品甲状旁腺激素Natpara(2015年获批,是世界首个获得FDA批准的处方甲状旁腺激素)因注射剂中橡胶脱落而导致的橡胶颗粒被FDA强制召回。2021年,为弥补召回带来的影响并尽快推进Natpara重新上市,武田提交了一份关于Natpara的事先批准补充(PAS),但因为仍然存在较大的安全隐患被FDA于2022年拒绝。2024年,因Natpara迟迟无法推进,武田决定终止其上市;至此,斥资620亿美元收购的Natpara仅达成2.3亿美元的销售额就退出市场,对武田制药造成了重大打击。
2021年Moderna因为在日本销售的新冠疫苗中检测出颗粒物而紧急召回163万支涉案疫苗,后发现系瓶塞模块的“星形轮”和“瓶塞供给装置”两个部件的安装所带来的摩擦而导致的可见异物问题。2022年,Moderna委托西班牙ROVI制药公司生产的COVID-19疫苗被反馈存在可见异物问题,再次被召回,召回数量高达76.49万剂。
颗粒物来源及检测方法
1.1 颗粒物来源:生产、流通、使用各环节均易产生颗粒物
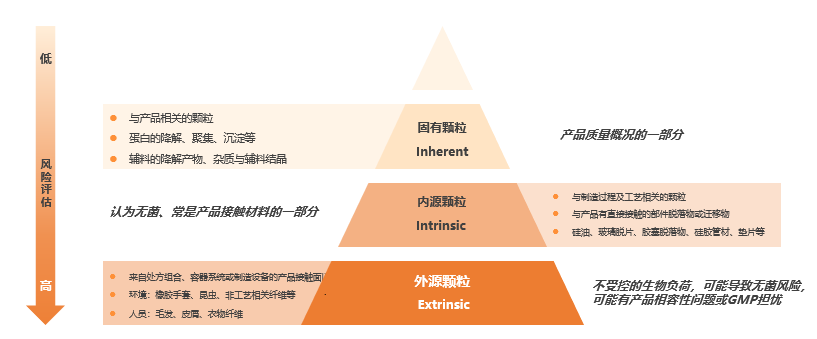
生物制剂中的颗粒物按照风险程度由低到高可分为固有颗粒、内源颗粒与外源颗粒。外源性颗粒为来自于环境、设备、包装和人为的颗粒,由于生产过程中颗粒的产生是无法避免的,因此药物制剂中的颗粒也无法完全清除。而内源性颗粒的产生则与制剂配方有关,包括活性成分、辅料、工艺残留、污染及制剂与包装的相互作用。固有颗粒则是与产品直接相关的颗粒,往往由产品自发形成,例如:单克隆抗体与新型生物药制剂 (如融合蛋白) 会自发聚集成可见颗粒;蛋白质颗粒主要由蛋白质聚集形成,比如说由界面应力引发的聚集;辅料颗粒据以往报告是由常用的表面活性剂 (如吐温) 降解形成的,导致药物制剂内不溶性降解产物的形成 (如脂肪酸)。目前随着mRNA药物,双特异性抗体等创新药及高浓度制剂、预充针、自动给药等新剂型产品的兴起,产品面临的颗粒问题也越来越多。
1.2 颗粒物检测方法学:用于不同场景,功能需求各异,核心功能划分为CQA生产质控和分析研究
医药产品中的颗粒物一般在上市产品中有法律法规强制标准,或者以行业标准的形式来制定,因此在产品放行时需要进行质控,而为了降低沉没成本,颗粒物的控制往往在前序研究中就已经开始关注,因此涉及到研发,工艺涉及,生产工程等环节,几乎涵盖了药物的全生命周期。
对于颗粒物检测分析,目前没有一款仪器可以满足所有需求,所以往往需要多种方法结合,来完成分析表征。
目前较为常用的表征识别方法包括光阻法(LO)、显微计数法、微流成像颗粒分析技术(MFI)、动态图像分析(DIA)等等,而表征鉴定方法主要有显微红外光谱、显微拉曼光谱、SEM-EDS等。目前,多个国家药典规定注射剂亚可见颗粒物放行检测需采用光阻法(LO)或显微计数法。美国药典1787推荐了微流成像颗粒分析技术作为大小和形态表征重要的方法;2021年中国食品药品检定研究院发表文章,详细比较了微流成像颗粒分析方法和光阻法对17种单克隆抗体的亚可见微粒分析结果,显示了微流成像颗粒分析技术在准确性方面具有优势,未来可能用于放行质量控制和稳定性研究。
市场概述
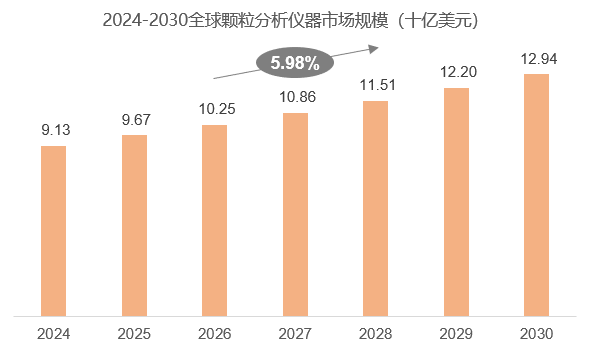
全球颗粒物检测分析市场呈现出稳步增长的趋势。据统计,2024年全球颗粒分析仪器市场规模可达91.3亿美元,预计2030年将增至129.4亿美元,年复合增长率(CAGR)为5.98%(2024-2030)。在细分市场中,粒度仪占据主导地位,其市场份额明显领先,其后分别为颗粒表征、Zeta电位等领域。
市场驱动力
3.1 医疗行业药典法规五年一大修,监管趋严
由于注射剂中的颗粒物会为病患带来巨大的潜在临床风险,各国对于颗粒物控制高度重视。从各国药典的更新进程来看,对于颗粒物检测的要求正在精细化、广泛化。
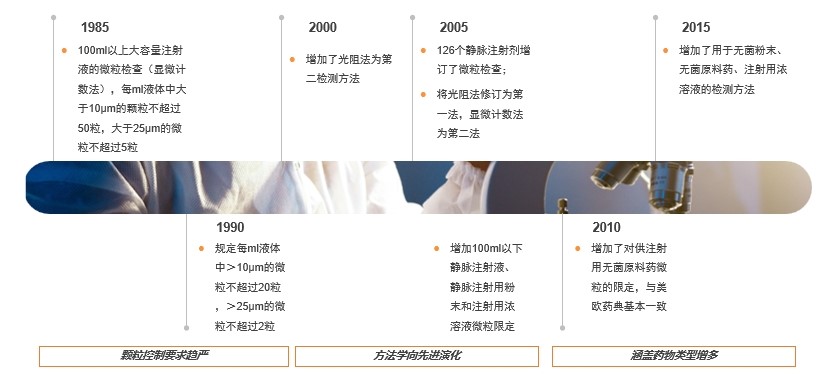
以中国药典为例,在过去20年间,一方面收紧了不溶性微粒最大含量,另一方面多次扩大检测范围,表现了相关部门对于监管条例的不断细化。
2017年,经过近7年的探讨与测试,UPS增加灵敏度更高、检测范围更广的微流图像法作为检测第三法,再一次印证了监管部门对于药物中不溶性微粒的高关注度。总结来说,监管部门通过细化检测要求的方式督促各药企降低不溶性微粒含量、减少不溶性微粒体积。因此,各药企需要不断迭代自有颗粒检测仪器,提高自检频率,改善生产工艺以最大程度契合管理规范。作为生物医药衍生市场,颗粒检测仪器市场规模自然而然被带动起来,实现行业的快速增长。
3.2 自动化,大数据处理将更适配现代制药工业应用
根据现行工业放行方法,>100μm的颗粒物需采用灯检(人眼识别)的方式进行检测,1-100μm的颗粒物则需根据药典规定采用光阻法或显微计数法进行判读。然而,人眼识别误检概率高、效率相对较低。而光阻法与显微计数法虽然一定程度上替代了人眼识别,但是仍然无法实现智能化的大数据处理,仍然存在耗时长,漏检,准确性低的问题。
近年来,随着科技的逐步成熟,自动化技术与AI大数据的介入使得颗粒分析方法得到进一步完善,提高可靠度以及稳定度。自动视觉检测(automated vision inspection)及半自动检测(semi-automated inspection)的推出有效地增强了信息获取能力与检测稳定性。其主要工作原理为使用电子设备(如显微镜等)取像,再交由专业人员进行检测,结合电子影像以及人脑完成判读。对于更精细化的应用场景,更是结合了自动化光学检测技术(Automated Optical Inspection),通过电子影像及电脑算法判断输出检测结果,提高产品检测速度,降低因人的失误而导致的错误率。针对较小的1-100μm的颗粒物,自动化判读与扫描式AI大数据处理及生成技术直接替代了人工判读过程,大大降低了人为错误率与漏检概率。
随着更多的先进技术被有机地结合进已有的颗粒分析方法中,颗粒检测仪器使用门槛降低,准确率增加,企业需求量也随之大大增加。
3.3 新型液体药物制剂的快速增长
目前,我国药典仅针对注射液剂量大小进行规定,一般将其分为大剂量(大于100ml)和小剂量(小于100ml)两种。相比之下,美国对注射液的分类更为细致,独立区分为抗体注射剂、其他注射液和眼用滴液等,对于不同注射液类型出台不同的规范标准。随着近年来大分子药物、基因治疗等新型治疗方式的发展,注射剂型成为了这些先进药物的主要载体,例如国内以君实生物PD1单抗药物为标志的国内抗体药物爆发增长(2018),以Daiichi Sankyo ADC药物为标志的ADC开发热潮(2019),均以注射液的形式于国内审批上市并准备出海欧美地区。在刚刚过去的2023年10月,《0903不溶性颗粒检测法草案公示稿(第一次)》已将监管范围从静脉注射剂(IV)扩展到所有注射剂类型,包括肌肉注射,皮下注射等类型。因此,预期未来强制检测的药物品种会随着新技术的应用而逐年增加,考虑到创新药保密因素与送检时间成本,自建分析平台对于具有一定规模的药企来说是一种趋势,颗粒分析仪器会逐渐成为药企刚需。
3.4 伴随医药出海,对接FDA标准
随着医保控费成为大趋势,单一化的国内医药市场已经难以满足不断增长的国产创新药商业化需求,越来越多的药企将目光转向海外市场。近年来,“药物出海”已成为行业的热点话题,多款新药成功进入欧美市场。根据医药魔方的最新数据显示,2023年国内共进行了近70次创新药license-out交易,相较去年同期增长32%。就交易金额而言,2023年已披露的license-out交易总额超过465亿美元,较同期增长69%。随着出海热潮,在产品研发阶段即与FDA标准保持一致已成为大势所趋。
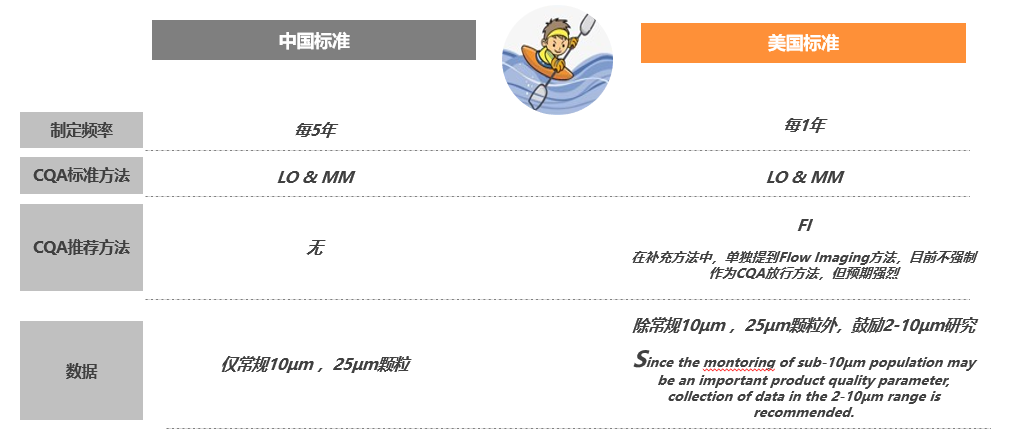
对比USP的颗粒物检测标准,中国标准迭代速度慢,可采用检测技术少,要求相对较低。颗粒分析控制涉及到药物开发的全周期,例如候选分子阶段需要评估蛋白分子是否会形成不溶性微粒风险;商业化生产阶段需要保持批间稳定性,分批次收集、分析颗粒物数据;后期若发现颗粒物则需要进行溯源调查。为实现稳定的研发生产流程、降低药物上市成本,走在监管之前,按照更严格的标准进行颗粒分析尤为重要。
3.5 赛道延展:医疗器械、新材料、新能源等行业的颗粒分析需求
除医药行业以外,颗粒物检测分析的必要性在多个领域均有体现。尤其在精密洁净加工,使用碾磨或研磨工艺的行业中,粒度是决定制造工艺效率和最终产品性能的一个主要方面。

大部分固体材料均是由各种形状不同的颗粒构造而成,细微颗粒材料的表征对材料结构和性能具有重要的影响。尤其是对于纳米级别的材料,其颗粒大小和形状对材料的性能起决定性作用。因此,在纳米金属有机材料、纳米陶瓷、石墨烯、涂料、高分子塑料等领域,颗粒粒径大小及分布分析有强需求性。
大部分固体材料均是由各种形状不同的颗粒构造而成,细微颗粒材料的表征对材料结构和性能具有重要的影响。尤其是对于纳米级别的材料,其颗粒大小和形状对材料的性能起决定性作用。因此,在纳米金属有机材料、纳米陶瓷、石墨烯、涂料、高分子塑料等领域,颗粒粒径大小及分布分析有强需求性。
相关参考标准:
GB/T 23413-2009 纳米材料晶粒尺寸及微观应变的测定 X射线衍射线宽化法
GB/T 41204-2021《纳米技术 纳米物体表征用测量技术矩阵》

在锂基电池材料的制造领域,颗粒分析技术被广泛应用于优化电池性能。多篇国内外研究均详细论述了如何通过精确控制电池正极材料的粒径来提高电池的能量密度和循环寿命。锂硫电池、锂离子电池以及硅基负极材料的研究都指出,粒径控制在提高电池性能方面的重要性。这些应用不仅对电池的能量密度和寿命有积极影响,而且在电动车和电网储能系统中具有重大意义。
另一方面,对于第四代发电技术——燃料电池而言,颗粒分析可以解决燃料电池开发和优化方面的许多问题,例如质子交换膜燃料电池 (PEMFC) 中的聚合物稳定性、固体氧化物燃料电池 (SOFC) 的原位结构变化以及催化剂效率等。随着全球燃料电池市场的迅速增长,颗粒分析仪器的应用迅速增加。
相关参考标准:
GB∕T 24533-2019 锂离子电池石墨类负极材料
GB/T 30836-2014 锂离子电池用钛酸锂及其炭复合负极材料
颗粒分析同样可用于分析并控制医疗设备和产品所需材料的颗粒大小、形状、与分布。例如,纳米尺寸的羟基磷灰石、氧化锆、氧化锌、银等材料普遍用于人工关节、义齿、组织修补材料、敷料等医疗器械产品。这些材料在体内应用过程中随磨损或腐蚀会有脱落和释放纳米颗粒的风险,从而引起生物安全性隐患。临床医学中,医疗器械中材料的颗粒脱落和释放的表征,如数量浓度、粒径、粒径分布、元素组成及含量等,是评估其机械性能和生物安全性的重要参考数据。因此,表征体内应用过程中脱落和释放的颗粒至关重要。
介入医疗器械近年蓬勃发展,但是随之而来的医疗问题也逐渐显露,因此在2023年4月,国家药品监督管理局医疗器械技术审评中心发布了《药物涂层球囊扩张导管注册审查指导原则》及《血管内回收装置注册审查指导原则》要求或建议进行微粒表征,预示着这块儿庞大的市场即将纳入监管。
结语
颗粒物很小,以至于我们会忽略它的存在,颗粒物检测分析又很重要,以至于影响百亿美金的产品商业化。在这个技术不断往深度发展,颗粒物也将从我们认为的“小物体”变成“大杂质”,也将迎来真正的发展时代。

Malvern Panalytical是全球知名的科学仪器公司,成立于1963年,位于英国马尔文城。公司前身是英国国防工业实验室。1970年制造出世界第一台商用激光并成立公司,随后生产出世界上第一台激光PCS纳米粒度及Zeta电位分析仪,第一台超声粒度分析仪,成为粒度分析技术的先锋及行业标准。2017年1月1日,同隶属于思百吉集团旗下的马尔文和帕纳科正式合并,且正式更名为“Malvern Panalytical”(“马尔文帕纳科”)。2022年营收将近7亿英镑。

胤煌科技成立于2020年底,是国内最早专业从事颗粒物检测分析仪器开发的公司,提供相关仪器的自动化、智能化解决方案,并且建立了颗粒物检测服务平台及数据云平台,为国内外客户提供综合解决方案,目前产品已经涉足生物医药、医疗器械、新材料、新能源、半导体等赛道。
相关内容基于已公开的资料或信息撰写,但本公司不保证该等信息及资料的完整性、准确性,所含信息及资料保持在最新状态。同时,本公司有权对本报告所含信息在不发出通知的情形下做出修改,阅读者应当自行关注相应的更新或修改。在任何情况下,本篇文章中的信息或所表述的意见均不构成对任何人的投资建议,无论是否已经明示或暗示,本报告不能作为道义的、责任的和法律的依据或者凭证。在任何情况下,本公司亦不对任何人因使用本文章中的任何内容所引致的任何损失负任何责任。本文章仅为本公司所有,未经事先书面许可,任何机构和个人不得以任何形式翻版、复制、发表、转发或引用本报告的任何部分