一、巨大未被满足的临床需求
术后高复发率仍是实体瘤患者长期生存的巨大挑战
近年来,实体瘤的异质性和患者术后高复发率是临床治疗中亟待解决的关键难题。虽然围绕可手术切除实体瘤的新辅助、术后辅助及围术期治疗(包括化疗、放化疗、靶向、化免联合治疗等)有了长足的发展,在一定程度上降低了患者术后复发或转移的风险,延长了患者的无复发生存期和总生存期。但是,恶性肿瘤患者复杂的病理学特征、多样的分子生物学特征、手术切除范围局限性、新辅/术后辅助治疗的不足等多种因素与疾病复发或转移密切有关。因此,恶性实体瘤患者即便进行了根治性切除手术及相关治疗,体内仍可能存在微小残留病灶(MRD),导致肿瘤的复发或远处转移。以几种典型实体瘤为例,其术后治疗情况如下:
非小细胞肺癌(NSCLC):2022年全球肺癌病例超220万,近180万人死亡,其中约85%为NSCLC [1]。早期NSCLC患者术后24个月复发率达55% [2],即便采用新辅助帕博利珠单抗联合化疗+手术+术后帕博利珠单抗辅助治疗,24个月复发率仍为37.6% [3]。肝细胞癌(HCC):2022年肝癌全球新发病例87万,死亡病例76万,约80%为肝细胞癌 [1]。早期HCC患者术后5年复发率高达70% [4],目前缺乏国际公认的标准辅助治疗方案。胰腺导管癌(PDAC):2022年胰腺癌总发病51万例,总死亡46万例,致死率极高,PDAC约占胰腺癌的90%以上[1]。约90%的患者术后7-9个月复发 [5],经多药化疗术后辅助治疗后,14个月复发率仍为80% [6]。三阴性乳腺癌(TNBC):2022年约230万女性确诊乳腺癌,67万死于该病,约15-20%为TNBC [1]。术后3年复发率为60-70% [7],采用帕博利珠单抗联合化疗+手术+术后帕博利珠单抗辅助治疗后5年复发率仍有37.4% [8]。
面对这一严峻挑战,个性化肿瘤疫苗(Personalized Cancer Vaccine, PCV)应运而生,为实体瘤患者术后治疗开辟新路径。在治疗策略上,个性化肿瘤疫苗并非取代传统疗法,而是通过与免疫检查点抑制剂联合治疗强化疗效。它一方面激活特异性T细胞扩增,另一方面与免疫检查点抑制剂协同,解除肿瘤微环境的免疫抑制,形成“双管齐下”的杀伤机制,显著提升对肿瘤细胞的杀伤效果。
更值得关注的是,个性化肿瘤疫苗具备预防复发、构建长期免疫记忆、安全性可控的独特优势。个性化肿瘤疫苗在患者体内可诱导形成记忆T细胞,通过持续激活免疫系统形成“哨兵效应”,时刻监控并清除患者体内残留癌细胞或微小转移灶,消灭潜在的复发隐患,从根本上实现对肿瘤复发的有效防控,为患者提供持久保护。这种长期免疫记忆的建立,是现有治疗手段难以比拟的,为攻克实体瘤术后复发难题提供了核心突破口,有望突破传统治疗的瓶颈。
二、个性化肿瘤疫苗:癌症治疗的精准革命
个性化肿瘤疫苗的核心原理是利用患者肿瘤特异性抗原的遗传信息,指导人体细胞自主合成抗原肽段,从而激活免疫系统。其制备过程可分为以下关键步骤:
通过高通量测序技术,对患者肿瘤组织及正常组织的基因组进行对比,识别肿瘤细胞特有的突变位点(如单核苷酸变异、插入缺失、移码突变等)。这些突变可能产生异常氨基酸片段,即新抗原(neoantigens),它们仅存在于肿瘤细胞表面,而正常细胞不表达,特异性极强。
基于筛选出的新抗原序列,设计编码对应抗原肽段的串联mRNA序列。为提高稳定性和翻译效率,mRNA需进行化学修饰(如N1-甲基假尿苷替换尿苷),并添加及修饰5’帽结构和polyA尾等。例如,Moderna公司的mRNA-4157疫苗可编码多达34种新抗原,覆盖患者肿瘤的多个突变靶点。
裸露的mRNA易被核酸酶降解且难以穿透细胞膜,因此需借助递送载体。目前主流方案是脂质纳米颗粒(LNP),其通过包裹mRNA形成纳米级颗粒,保护其稳定性并促进细胞摄取。
疫苗注射后,LNP包裹的mRNA进入抗原呈递细胞(如树突状细胞)。细胞质内的核糖体翻译mRNA生成抗原肽段,后者在胞内经蛋白酶体水解为肽段,通过与MHC I类分子结合呈递至细胞表面。树突状细胞作为“免疫指挥官”,将抗原信息传递给CD8+ T细胞,激活其杀伤功能;同时,经MHC II类分子呈递的抗原可激活CD4+ T细胞和B细胞,形成体液免疫应答。
图1. 个性化肿瘤新生抗原疫苗制备示意图方法 [9]
个性化肿瘤疫苗在激活免疫系统的同时,呈现出多维度、多层次机制增强抗肿瘤免疫。mRNA疫苗注射后,被局部的树突状细胞(DCs)摄取,随后在细胞内翻译为抗原肽段,并加工为抗原肽,与MHC Ⅰ类或Ⅱ类分子结合形成复合物,呈递至DC表面。成熟的DC迁移至引流淋巴结,将抗原-MHC复合物呈递给T细胞。T细胞通过T细胞受体(TCR)识别相应的抗原–MHC复合物,并在共刺激分子(如CD80/CD86与CD28结合、OX40L与OX40结合)及细胞因子(如I型干扰素、IL-12、IL-1)的作用下被激活并增殖。激活的T细胞在趋化因子(如CCR7、CCL5、CXCL9/10)的引导下,向肿瘤组织迁移并浸润,进而分泌效应分子(如IFN-γ、TNF、穿孔素和颗粒酶),发挥抗肿瘤效应。其中,内源性抗原通常通过MHC Ⅰ类分子呈递,激活细胞毒性CD8⁺ T细胞,其对靶细胞具有直接杀伤作用;而外源性抗原则主要通过MHC Ⅱ类分子呈递,激活辅助性CD4⁺ T细胞,调节和增强免疫应答。激活的T细胞分化为记忆T细胞,长期留存于体内,对肿瘤复发形成持续监控。
三、个性化mRNA肿瘤疫苗最新临床研究结果优异
1.BioNTech & Genentech,BNT122 (Autogene cevumeran):
BNT122是由BioNTech和罗氏旗下基因泰克(Genentech)联合开发的一款个性化新抗原mRNA肿瘤疫苗,可编码多达20种患者肿瘤新抗原。疫苗通过静脉注射给药进入人体,mRNA引导宿主细胞表达新抗原,激活CD8⁺和CD4⁺ T细胞,特异性攻击携带这些抗原的癌细胞。BNT122目前处于临床II期研究阶段,主要针对胰腺导管腺癌(PDAC)和结直肠癌术后辅助治疗。
2025年2月19日,纪念斯隆·凯特琳癌症中心的研究团队在《Nature》期刊上报道了Autogene cevumeran(BNT122)用于切除胰腺导管腺癌(PDAC)患者的术后辅助治疗I期临床试验最新结果 [10]。该试验纳入34例胰腺癌患者,其中28例患者接受了手术。19例患者在术后接受了抗PD-L1免疫检查点抑制剂阿特利珠单抗(Atezolizumab)治疗,其中16例患者接受了BNT122疫苗接种,15例患者接受了改良版四药化疗方案(mFOLFIRINOX)。
结果显示,BNT122与阿替利珠单抗和mFOLFIRINOX化疗联用方案,在切除PDAC患者中显著推迟了复发时间,诱导大量新抗原特异性、功能性和持久性的CD8⁺活性T细胞。BNT122肿瘤疫苗诱导的CD8⁺T细胞克隆平均寿命达7.7年,部分克隆甚至可能比患者寿命更长。
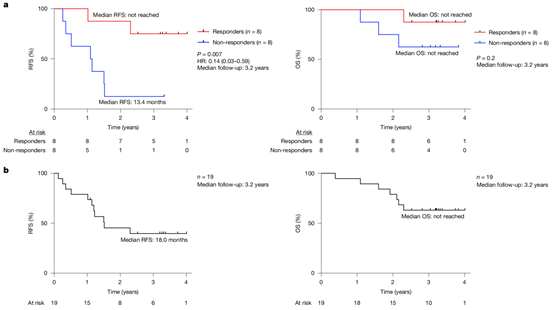
在生物标志物可评估队列中,经过3.2年(2.3-4.0年)的中位随访,8名接受mRNA肿瘤疫苗并产生了大量新抗原特异性的T细胞响应的患者(免疫应答者),中位无复发生存期(RFS)尚未达到终点;而8名未产生抗原特异性T细胞的患者(非应答者),中位RFS仅13.4个月(HR=0.14)。在安全性可评估队列中,中位RFS为18.0个月,中位总生存期(OS)未达到终点。由此可见,个性化mRNA肿瘤疫苗诱导的新抗原特异性T细胞应答情况或与胰腺癌术后复发紧密相关。
图2. 术后PDAC人群中,mRNA肿瘤疫苗诱导的免疫应答与延迟复发的相关性(3.2年随访) [10]
2.Moderna & MSD,mRNA-4157(V940,Intismeran autogene):
mRNA-4157是一款由Moderna与默沙东(MSD)联合研发的个性化mRNA肿瘤疫苗。患者通过肌肉注射接种疫苗后,mRNA携带的新抗原序列在患者体内被翻译成肽段,经抗原呈递后与T细胞结合,激发新抗原特异性T细胞抗肿瘤反应,并实现延迟复发与总生存的临床获益。
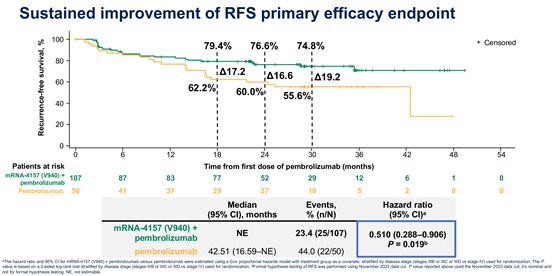
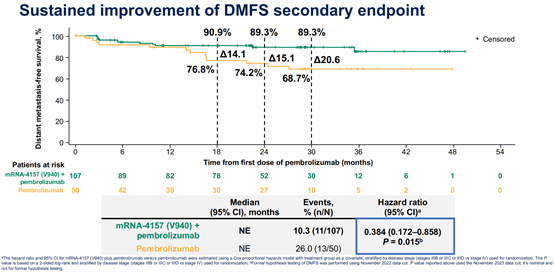
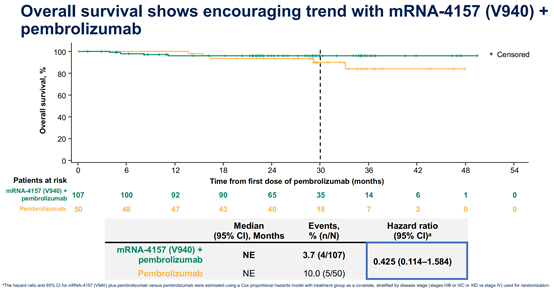
2024年6月3日,美国Moderna和MSD公司在2024年美国临床肿瘤学会(ASCO)年会上,公布了临床IIb期随机试验KEYNOTE-942/mRNA-4157-P201的3年随访结果结果[11]。该研究为一项多中心、随机、开放、2期对照研究,旨在评价个体化新抗原mRNA肿瘤疫苗mRNA-4157(V940)联合PD-1抗体帕博利珠单抗术后辅助治疗手术切除高复发风险黑色素瘤(Ⅲ/Ⅳ期)患者的有效性和安全性。据本次会议报道,在中位随访期3年(34.9个月)中,与帕博利珠单抗单药相比,mRNA-4157与帕博利珠单抗联合治疗可使患者的复发或死亡风险降低49%(HR=0.510,95% CI:0.288–0.906;双侧p值=0.019)(图3),远处转移或死亡风险降低62%(HR=0.384,95% CI:0.172-0.858;双侧p值=0.015)(图4)。3年随访也呈现出令人鼓舞的生存差异趋势。mRNA-4157联合帕博利珠单抗组与帕博利珠单抗单药组的2.5年总生存率分别为96.3%和90.0%(HR=0.425,95% CI:0.114 – 1.584)(图5)。
3年安全性随访结果表明,mRNA-4157联合帕博利珠单抗与前期分析结论一致,具有可管理的安全性,相比帕博利珠单抗单药没有特别的免疫相关不良事件发生。最常见的不良事件是疲劳(60.6%)、注射部位疼痛(56.7%)、寒战(49.0%)、发热(48.1%)、头痛(31.7%)、注射部位红肿(31.7%)、流感样症状(29.8%)、恶心(25.0%)和肌痛(21.2%),严重程度多为1-2级,仅有4.8%疲劳、1.0%发热和1.0%肌痛为3级不良事件,无4-5级不良事件发生。
2023年,FDA和EMA分别授予V940联合帕博利珠单抗用于高危黑色素瘤患者的术后辅助治疗的突破性疗法认定和PRIME资格。
目前,两家公司已启动多项后续研究,涵盖高危黑色素瘤、非小细胞肺癌的III期研究,肾细胞癌、尿路上皮癌的II期研究,以及皮肤鳞状细胞癌的II/III期研究。
图3. mRNA-4157+帕博利珠单抗vs帕博利珠单抗RFS曲线 [11]
图4. mRNA-4157+帕博利珠单抗vs帕博利珠单抗DMFS曲线 [11]
图5. mRNA-4157+帕博利珠单抗vs帕博利珠单抗OS曲线 [11]
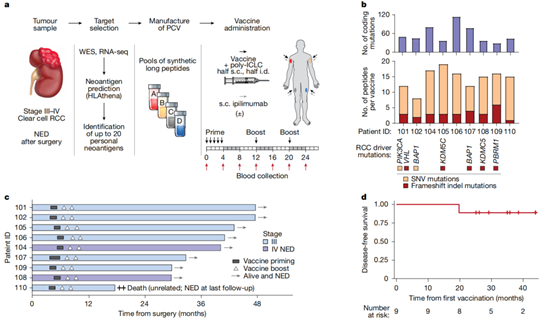
3.Dana-Farber癌症研究所在Nature发表PCV在RCC方面的研究:
本研究开展了一项I期临床试验 [12],评估靶向新抗原的PCV在高危、完全切除的透明细胞肾细胞癌(RCC,III期或IV期)患者中的疗效,部分患者联合疫苗邻近给药伊匹木单抗。在术后中位随访40.2个月时,入组的9例患者均未出现RCC复发,且未观察到剂量限制性毒性。所有患者均对NeoVaxPCV抗原产生新抗原特异性T细胞免疫应答,包括针对RCC驱动突变VHL、PBRM1、BAP1、KDM5C和PIK3CA的应答。疫苗接种后,外周血T细胞克隆呈现持续性扩增。此外,7/9例患者检测到针对自体肿瘤的T细胞反应活性。本研究结果表明,靶向新抗原的PCV在RCC中具有高度免疫原性,能够靶向关键驱动突变并诱导抗肿瘤免疫应答。结合该研究中全部9例接种患者均未复发的临床获益结局,证实NeoVaxPCV作为RCC术后辅助治疗具有显著的临床应用前景。
图6. NeoVax PCV的生产过程和临床随访结果 [12]
四、个性化mRNA肿瘤疫苗或成为
中国生物医药突围的新战场
新冠疫情曾让mRNA疫苗从实验室走向全球市场,辉瑞/BioNTech、Moderna的产品创下年销售额超500亿美元的神话。在后疫情时代的生物医药领域,mRNA技术正经历从新冠疫苗到肿瘤治疗的战略转向,肿瘤治疗的复杂性为mRNA技术提供了天然舞台。不同于传统疗法,mRNA疫苗可通过编码患者特异性肿瘤新抗原激活免疫系统,精准攻击肿瘤细胞,在应对肿瘤异质性和免疫抑制微环境上展现独特优势,在实体瘤术后辅助治疗领域具有巨大临床开发价值。随着Moderna宣布2027年首款个性化mRNA肿瘤疫苗或将上市,个性化mRNA肿瘤疫苗的商业化元年即将到来。国内多款个性化与通用型产品也相继进入临床阶段,中国生物医药企业也站在了这场技术革命的潮头!
以mRNA领域的代表性企业Moderna的肿瘤疫苗为参考,目前关于肿瘤疫苗的技术路径和商业化博弈存在于个性化定制和通用型的选择。Moderna研发进度最快的肿瘤疫苗是与默沙东联合开发的个性化肿瘤疫苗mRNA-4157/V940,如前文所述已经取得了非常积极的临床结果。相比通用性肿瘤疫苗,个性化肿瘤疫苗具有更高的靶向性和精准性,可精准针对不同患者的肿瘤细胞独特突变以激活特异性免疫响应,具备更强的免疫原型的同时减少对正常组织损伤,并且更为适应实体瘤复杂的肿瘤微环境和异质性,避免了通用型肿瘤疫苗可能因为靶向共有抗原低表达或免疫不耐受导致的应答率低、适用范围受限等不足。
国内企业方面,瑞宏迪医药及其全资子公司广州瑞领医药共同自主研发的国内首款针对恶性实体瘤术后预防复发的个性化新抗原mRNA疫苗RGL-270注射液已于2025年4月24日获国家药监局临床试验申请IND默示许可。RGL-270注射液是国内首个获批IND的个性化mRNA肿瘤疫苗产品,注册路径得到验证。
康方生物也正加速布局个性化肿瘤疫苗领域,其个体化mRNA疫苗AK154联合PD-1/CTLA-4双抗(AK104)、PD-1/VEGF双抗(AK112)的IIT临床试验已启动,目标直指胰腺癌这一“癌王”。该方案通过新抗原激活特异性T细胞,与双抗解除免疫抑制、重塑肿瘤微环境的机制形成互补,形成“疫苗+双抗”协同体系。
上述布局反映了行业对个性化疫苗与免疫疗法联用的高度关注。拥有PD-1/PD-L1管线的企业正积极布局联合疗法以拓展适应症,已为个性化肿瘤疫苗企业打造了国际化研发合作的舞台。
因诺纬克生物,在mRNA序列设计与优化、LNP递送系统等平台技术上布局多项专利,并与海外顶尖高校展开合作引入mRNA尾部修饰等前沿专利技术,并已成功申请多项国际PCT专利。公司同时具备独特的密码子优化算法,确保mRNA的高效翻译。另外具有独有的AI计算生物学平台整合InnoBINF、InnoRank和InnoOptimize三大核心系统筛选出患者特异性的肿瘤新抗原,可全面解析肿瘤新抗原库、智能优选免疫反应潜力最高靶点、并同时进行mRNA载体结构优化和密码子优化,最高可装载50个肿瘤新抗原。通过工艺的迭代优化,因诺纬克生物可在获得测序数据后的30天内完成生产、检定及临床给药,目前已成功交付多批临床批次。因诺纬克研发的个性化肿瘤疫苗InnoPCV首个探索性临床研究,于2024年7月启动,目前已完成剂量爬坡队列患者入组并持续收集数据中,初步结果积极。
五、未来展望:
从“被动防御”到“主动免疫”的全病程管理
随着两年前英国政府与BioNTech建立个性化mRNA肿瘤免疫疗法战略合作伙伴关系,全球已有超200项个性化癌症疫苗临床试验展开。未来可能渗透癌症治疗全周期:早期患者术后接种以清除微小残留病灶,中晚期联合治疗提升响应率,甚至高危人群可通过预防性疫苗阻断癌变。个性化肿瘤疫苗也有望成为继手术、放化疗、靶向药后的第四大癌症治疗支柱,引领“精准抗癌”进入“一人一方”的崭新时代!
[1] Bray, F., et al. CA Cancer J Clin, 2024
[2] J Thorac Cardiovasc Surg. 2024 Jun 29:S0022-5223(24)00548-8
[3] Wakelee, H., et al., N Engl J Med, 2023
[4] Llovet, J.M., et al., Nat Rev Clin Oncol, 2024
[5] Neoptolemos, J.P., et al..N Engl J Med, 2004
[6] Park, W., Chawla, A. & O’Reilly, E. M. JAMA 326, 851–862 (2021)
[7] Dent R, et al.J Clin Oncol. 2007;25(8):1270-1275
[8] Schmid, P., et al., Cancer Research, 2024
[9] Katsikis PD, et al., Nat Rev Immunol. 2024
[10] Sethna Z, et al., Nature.2025
[11] Jeffrey S. Weber, et al., ASCO Annual Meeting, 2024
[12] Braun DA, et al., Nature. 2024